
(15分)用NH3催化还原NxOy可以消除氮氧化物的污染。
已知:反应I:4NH3(g)+6NO(g)  5N2(g)+6H2O(l) △H1
5N2(g)+6H2O(l) △H1
反应II:2NO(g)+O2(g)  2NO2(g) △H2 (且|△H1| =2|△H2|)
2NO2(g) △H2 (且|△H1| =2|△H2|)
反应III:4NH3(g)+6NO2(g)  5N2(g)+3O2(g)+6H2O(l) △H3
5N2(g)+3O2(g)+6H2O(l) △H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
298 | K1 | K2 | |
398 | K1′ | K2′ |
(1)推测反应III是 反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
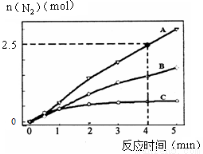
①计算0~4分钟在A催化剂作用下,反应速率v(NO)= 。
②下列说法正确的是 。
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO) ∶n(O2)∶n(NO2)=2∶1∶2。在其它条件不变时,再充入NO2气体,分析NO2体积分数——φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2) ;恒温恒容容器,φ(NO2) 。
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3 L,c(N2)与反应时间t变化曲线X如下图所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z。则:

①变为曲线Y改变的条件是 。变为曲线Z改变的条件是 。
②若t2降低温度,t3达到平衡,请在上图中画出曲线X在t2- t4内 c(N2)的变化曲线。
科目:高中化学 来源:2014-2015学年湖北省等高三下学期期中四校联考化学试卷(解析版) 题型:选择题
中学阶级介绍的电解原理的应用主要有三种:一是氯碱工业、二是电解精炼铜、三是电解冶金。下列关于这三个工业生产的描述中正确的是
A.电解精炼铜时,负极反应式:Cu2++2e-=Cu
B.氯碱工业和电解精炼铜中,阳极都是氯离子放电放出氯气
C.在氯碱工业中,电解池中的阴极产生的是H2, NaOH在阳极附近产生
D.电解精炼铜时,应用粗铜作阳极、精铜作阴极,可溶性铜盐作电解质溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三二模考试理综化学试卷(解析版) 题型:选择题
下列实验操作或叙述正确的是
A.通过导电实验证明氢氧化铁胶体带正电
B.除去苯中溶有的少量乙醇,加入水,振荡,然后分液
C.进行蒸馏操作时.应用温度计准确测量沸腾液体的温度
D.从海带中提取碘时用到的药品有双氧水和NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三下学期期中考试理综化学试卷(解析版) 题型:简答题
【化学选修2-化学与技术】(15分)以硼镁矿(2Mg·B2O3·H2O·SiO2 )及少量Fe3O4、CaCO3 、Al2O3 )为原料生产硼酸的工艺流程如下:
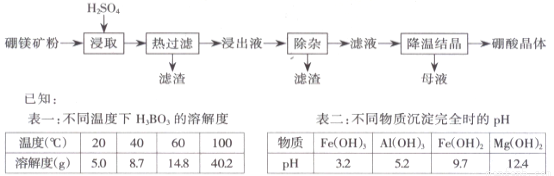
(1)由于矿粉中含CaCO3 ,“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施为_____。
(2)“浸出液”显酸性,含有H3BO3、Mg2+和SO42 -,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时,向浸出液中依次加入适量目H2O2和MgO,可以除去的杂质离子为_________,H2O2 的作用为_________(用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的为_______。
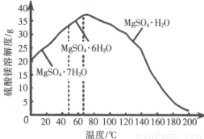
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图所示,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收 MgSO4.H2O,应采取的措施是将“母液”蒸发浓缩,____。
(5)已知25 ℃时,硼酸( H3BO3)溶液中存在如下平衡:
H3BO3(aq)+H2O(l) [B(OH)4]-(aq)+H+(aq) K=5.7×10-10;
[B(OH)4]-(aq)+H+(aq) K=5.7×10-10;
25 ℃时,0.7 mol·L-1硼酸溶液中c(H+)≈ mol·L-1.
(6)已知25 ℃时:
化学式 | H2CO3 | CH3COOH |
电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
下列说法正确的是_____________(填选项字母)。
A.碳酸钠溶液滴入硼酸溶液中能观察到有气泡产生
B.碳酸钠溶液滴入醋酸溶液中能观察到有气泡产生
C.等浓度碳酸溶液和硼酸溶液的pH:前者>后者
D.等浓度碳酸钠溶液和醋酸钠溶液的pH:前者>后者
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三下学期期中考试理综化学试卷(解析版) 题型:选择题
根据原子结构及元素周期律的知识,下列推断正确的是
A.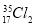 与
与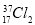 氧化能力相近,二者互为同位素
氧化能力相近,二者互为同位素
B.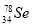 与
与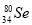 所含质子数相同,中子数不同
所含质子数相同,中子数不同
C.同主族元素形成的含氧酸的酸性随核电荷数的增加而减弱
D.同周期主族元素形成的简单离子半径随核电荷数的增大而减小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三4月阶段测试理综试卷化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.激素类药物乙烯雌酚的结构简式为: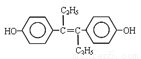 ,它的分子式是:C18H20O2
,它的分子式是:C18H20O2
B.等质量的甲烷、乙烯、乙醇分别充分燃烧,所耗用氧气的量依次减少
C.聚乳酸(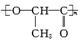 )是由单体之间通过加聚反应合成的
)是由单体之间通过加聚反应合成的
D.实验证实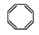 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键
可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省金华十校高三下学期高考模拟(4月)理综化学试卷(解析版) 题型:填空题
煤的气化产物CO和H2是重要的化工原料。某些简单的有机物和CO反应合成具有优良性能材料的基本过程如图所示。
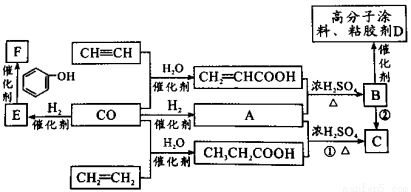
已知:①E由CO和H2按物质的量之比为1:1完全反应而成;
②A由CO和H2按物质的量之比为1:2完全反应而成。
回答下列问题:
(1)E的结构简式 ;B中的官能团名称 。
(2)下列说法不正确的是 。
A.HC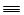 CH可以与氯化氢反应,得到氯乙烯
CH可以与氯化氢反应,得到氯乙烯
B.CH2=CH2可由石油裂化得到,一定条件下可制得聚乙烯塑料
C.由B生成D的反应类型是加聚反应
D.可用溴水鉴别CH3CH2COOH与CH2=CHCOOH
(3)写出反应①的化学方程式 ,属于 反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
要鉴别己烯中是否混有少量甲苯,正确的实验方法是( )
|
| A. | 先加足量的酸性高锰酸钾溶液,然后再加入溴水 |
|
| B. | 先加足量溴水,然后再加入酸性高锰酸钾溶液 |
|
| C. | 点燃这种液体,然后再观察火焰的颜色 |
|
| D. | 加入浓硫酸与浓硝酸后加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:Fe2O3(s)+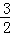 C(s)═
C(s)═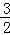 CO2(g)+2Fe(s)△H=+234.1kJ/mol
CO2(g)+2Fe(s)△H=+234.1kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
则:2Fe(s)+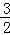 O2(g)═Fe2O3(s)的△H是()
O2(g)═Fe2O3(s)的△H是()
A. ﹣824.4 kJ/mol B. ﹣627.6 kJ/mol
C. ﹣744.7 kJ/mol D. ﹣169.4 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com