
根据原子结构及元素周期律的知识,下列推断正确的是
A.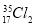 与
与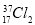 氧化能力相近,二者互为同位素
氧化能力相近,二者互为同位素
B.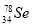 与
与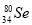 所含质子数相同,中子数不同
所含质子数相同,中子数不同
C.同主族元素形成的含氧酸的酸性随核电荷数的增加而减弱
D.同周期主族元素形成的简单离子半径随核电荷数的增大而减小
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源:2014-2015学年湖北省等高三下学期期中四校联考化学试卷(解析版) 题型:选择题
(A)下列各种叙述中正确的是
A.在CH2=CH2分子中,存在五个s—sp2σ键和一个π键
B.N、O、F电负性大小:F>O>N;第一电离能大小:F>O>N
C.酸性强弱:H2SO4>H2SO3>H2SeO3;岩浆晶出的先后顺序:SiO2、MgSiO3、CaSiO3
D.在共价化合物中,一定存在极性共价键,可能存在非极性共价键,一定不存在离子键
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三二模考试理综化学试卷(解析版) 题型:选择题
某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,
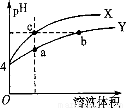
下列有关说法正确的是
A.加等量的水后硫酸中水电离出的C(H+)与硫酸铝中水电离出的C(H+)的比值比稀释前的比值增大
B.a点溶液中有:c(H+)+c(Al3+)=c(OH-)+c(SO42一)
C.体积和pH都相同的稀硫酸和硫酸铝溶液与等浓度的NaOH反应,消耗NaOH的体积相等
D.b、c两溶液水电离出的c(OH-)相等。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三下学期三调考试化学试卷(解析版) 题型:选择题
下列说法或解释不正确的是
A.等物质的量浓度的下列溶液中,
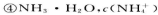 由大到小的顺序是①>②>③>④
由大到小的顺序是①>②>③>④
B.室温下,向0. 01 mol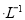 NH4HSO4溶液中滴加NaOH溶液至中性:
NH4HSO4溶液中滴加NaOH溶液至中性:
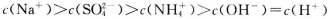
C.向0.2 mol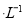 NaHCO3溶液中加入等体积0.1 mol
NaHCO3溶液中加入等体积0.1 mol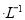 NaOH溶液:
NaOH溶液:
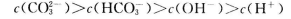
D.物质的量浓度均为1 mol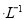 的NaCl和MgCl2混合液1L中,含有Cl-的数目为3
的NaCl和MgCl2混合液1L中,含有Cl-的数目为3 (
( 表示阿伏加德罗常数的值)
表示阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三下学期期中考试理综化学试卷(解析版) 题型:简答题
(15分)高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景。
(1)湿法制备K2FeO4:在KOH溶液中,用KC10直接氧化Fe(NO3)3即可制得K2FeO4。该反应的离子方程式为_________________________________。
(2)测定K2FeO4:样品纯度:i.称取样品mg,加入到盛有过量碱性亚铬酸钠[NaCr(OH)4]溶液的锥形瓶中充分反应;ii.将所得铬酸钠(Na2CrO4)溶液酸化;iii.在所得Na2Cr2O7溶液中加入8—9滴二苯胺磺酸钠溶液作指示剂,用c mol·L-1(NH4)2Fe(SO4)2溶液滴定至终点,消耗溶液体积为V mL。整个过程中发生的反应如下:
i. Cr(OH)4- + FeO42 -+  = Fe(OH)3 (H2O)3↓+ CrO42 -+
= Fe(OH)3 (H2O)3↓+ CrO42 -+
ii.2CrO42 -+2H+=Cr2O72 -+H2O;
iii.Cr2O72 -+6Fe2++14H+=2Cr3++6Fe3++7H2O
①配平方程式i;
②利用上述数据计算该样品的纯度为________________(用含字母的代数式表示)。
(3)高铁酸盐在水溶液中有四种含铁形体。25 ℃时,它们的物质的量分数随pH的变化如图所示:
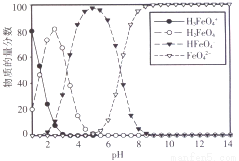
i.pH=2.2时,溶液中主要含铁形体浓度的大小关系为________;为获得尽可能纯净的高铁酸盐,pH应控制在______________。
ii.已知H3FeO4+ 的电离常数分别为:K1=2.51×10-2,K2=4.16×10-4,K3=5.01×10-8,当pH=4时,溶液中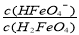 = 。
= 。
iii.向pH=6的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为______________。
(4)某新型电池以金属锂为负极,K2FeO4为正极,溶有LiPF6的有机溶剂为电解质。工作时Li+通过电解质迁移人K2FeO4晶体中,生成K2Li2FeO4。该电池的正极反应式为______________.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三4月阶段测试理综试卷化学试卷(解析版) 题型:简答题
(15分)用NH3催化还原NxOy可以消除氮氧化物的污染。
已知:反应I:4NH3(g)+6NO(g)  5N2(g)+6H2O(l) △H1
5N2(g)+6H2O(l) △H1
反应II:2NO(g)+O2(g)  2NO2(g) △H2 (且|△H1| =2|△H2|)
2NO2(g) △H2 (且|△H1| =2|△H2|)
反应III:4NH3(g)+6NO2(g)  5N2(g)+3O2(g)+6H2O(l) △H3
5N2(g)+3O2(g)+6H2O(l) △H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
298 | K1 | K2 | |
398 | K1′ | K2′ |
(1)推测反应III是 反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
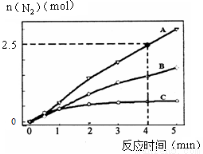
①计算0~4分钟在A催化剂作用下,反应速率v(NO)= 。
②下列说法正确的是 。
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO) ∶n(O2)∶n(NO2)=2∶1∶2。在其它条件不变时,再充入NO2气体,分析NO2体积分数——φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2) ;恒温恒容容器,φ(NO2) 。
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3 L,c(N2)与反应时间t变化曲线X如下图所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z。则:

①变为曲线Y改变的条件是 。变为曲线Z改变的条件是 。
②若t2降低温度,t3达到平衡,请在上图中画出曲线X在t2- t4内 c(N2)的变化曲线。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三4月阶段测试理综试卷化学试卷(解析版) 题型:选择题
下列说法正确的是
A.实验中要配制500 mL 0.2 mol·L-1 KCl溶液,需用托盘天平称量7.45g KCl固体
B.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
C.排除碱式滴定管尖嘴端气泡时,可以向上弯曲橡皮管,然后挤压玻璃球,排出气泡
D.往含有FeBr2和FeI2的混合溶液中通入足量的氯气,然后把溶液蒸干、灼烧,得到FeCl3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关有机物的叙述正确的是( )
|
| A. | 苯与乙烯均能与溴水发生加成反应,而甲烷只能与溴水发生取代反应 |
|
| B. | 煤井中的瓦斯气和家庭使用的液化石油气的主要成分都是甲烷 |
|
| C. | 苯的结构简式为 |
|
| D. | 利用酸性KMnO4溶液可鉴别乙烯和乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关能源与能量的说法正确的是()
A. 煤和石油是经过亿万年形成的,亿万年后煤和石油还会生成,故二者属可再生能源
B. 蒸汽属于一次能源
C. 凡经过加热而发生的反应都是吸热反应,常温下进行的反应都是放热反应
D. 反应物和生成物的总能量决定反应是放热还是吸热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com