
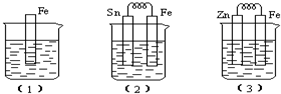
分析 (1)中铁和稀硫酸发生置换反应;
(2)中铁易失电子作负极、Sn作正极,负极上铁失电子发生氧化反应、正极上氢离子放电;
(3)该装置中,锌易失电子作负极、Fe作正极,作负极的金属易被腐蚀,金属腐蚀快慢顺序是:作原电池负极>化学腐蚀>作原电池正极的电极.
解答 解:(1)中铁和稀硫酸发生置换反应生成亚铁离子和氢气,电极反应式为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(2)该装置中Fe易失电子作负极、Sn作正极,负极电极反应为Fe-2e=Fe2+,发生氧化反应,正极电极反应为2H++2e=H2↑,溶液中氢离子放电导致溶液氢离子浓度降低,则溶液的酸性减弱,故答案为:Fe-2e=Fe2+;氧化;减弱;
(3)该装置中,锌易失电子作负极、Fe作正极,作原电池负极的金属易被腐蚀,所以被腐蚀的金属是Zn,电极反应为Zn-2e═Zn2+,Fe电极反应式为2H++2e-=H2↑,金属腐蚀快慢顺序是:作原电池负极>化学腐蚀>作原电池正极的电极,所以铁被腐蚀快慢顺序是(2)>(1)>(3),
故答案为:Zn;2H++2e-=H2↑;(2)>(1)>(3).
点评 本题考查了原电池原理,根据失电子难易程度确定正负极,知道金属腐蚀快慢顺序,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液 | B. | 悬浊夜 | C. | 乳浊液 | D. | 胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 利用如图装置进行实验,开始时,a、b 两处液面相平,密封好,放置一段时间.下列说法不正确的是( )
利用如图装置进行实验,开始时,a、b 两处液面相平,密封好,放置一段时间.下列说法不正确的是( )| A. | a 管发生吸氧腐蚀,b 管发生析氢腐蚀 | |
| B. | 一段时间后,a 管液面高于 b 管液面 | |
| C. | a 处溶液的 pH 增大,b 处溶液的 pH 减小 | |
| D. | a、b 两处具有相同的电极反应式:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氢氧化铜悬浊液可以检验病人是否患有糖尿病 | |
| B. | 四氯化碳是非极性分子,也是重要的有机溶剂 | |
| C. | 根据金属钠与水、乙醇、乙酸反应剧烈程度的不同,可以说明分子中羟基上氢原子的活泼性不同 | |
| D. | 蛋白质、淀粉、纤维素水解的最终产物都是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 体心立方是金属最密堆积形式 | |
| B. | NaCl晶体的配位数为4 | |
| C. | 24g金刚石中含有C-C键的个数为4NA | |
| D. | 中和热测定时,用铜棒代替环形玻璃棒会导致△H偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com