
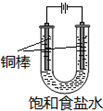
 CuCl是应用广泛的有机合成催化剂,可采取不同方法制取.
CuCl是应用广泛的有机合成催化剂,可采取不同方法制取. [CuCl3]2-(无色溶液)逆向移动,生成CuCl.
[CuCl3]2-(无色溶液)逆向移动,生成CuCl.分析 方法一:CuSO4溶液与NaCl、Cu粉、盐酸在加热条件反应得到[CuCl3]2-,过滤分离出未反应的Cu,滤液中含有CuCl3]2-,在水溶液中存在平衡:CuCl(白色)+2Cl-?[CuCl3]2-(无色溶液),加入水进行稀释,有利于CuCl沉淀的生成,再经过过滤分离,洗涤干燥得到CuCl.
(1)由题目信息可知,Cu、氧气与硫酸反应生成硫酸铜与水;
(2)加热可以加快反应速率,由于硫酸铜溶液为蓝色,而[CuCl3]2-为无色溶液,根据溶液颜色变化判断反应已经完全;
(3)加入水进行稀释,有利于CuCl沉淀的生成;
(4)潮湿的CuCl在空气中易发生水解和氧化,开始加入的浓盐酸及用酒精洗涤均可以抑制水解,在真空中干燥,不能与空气接触;
方法二:(5)利用电解原理制备CuCl,阳极发生氧化反应,Cu失去电子,与氯离子作用生成CuCl;
(6)由于Ksp(CuCl)远远大于Ksp(CuOH),开始没有CuOH生成,而是生成CuCl,说明氯离子浓度远远大于氢氧根离子浓度.
解答 解:方法一:CuSO4溶液与NaCl、Cu粉、盐酸在加热条件反应得到[CuCl3]2-,过滤分离出未反应的Cu,滤液中含有CuCl3]2-,在水溶液中存在平衡:CuCl(白色)+2Cl-?[CuCl3]2-(无色溶液),加入水进行稀释,有利于CuCl沉淀的生成,再经过过滤分离,洗涤干燥得到CuCl.
(1)由题目信息可知,Cu、氧气与硫酸反应生成硫酸铜与水,反应离子方程式为:2Cu+O2+4H+$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2++2H2O,
故答案为:2Cu+O2+4H+$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2++2H2O;
(2)升高温度,反应速率加快,①中“加热”的目的是:加快反应的速率,由于硫酸铜溶液为蓝色,而[CuCl3]2-为无色溶液,当观察到溶液由蓝色变为无色现象,即表明反应已经完全,
故答案为:加快反应的速率;溶液由蓝色变为无色;
(3)加入水进行稀释,促进平衡:CuCl(白色)+2Cl- [CuCl3]2-(无色溶液)逆向移动,生成CuCl,
[CuCl3]2-(无色溶液)逆向移动,生成CuCl,
故答案为:稀释促进平衡CuCl(白色)+2Cl- [CuCl3]2-(无色溶液)逆向移动,生成CuCl;
[CuCl3]2-(无色溶液)逆向移动,生成CuCl;
(4)潮湿的CuCl在空气中易发生水解和氧化,开始加入的浓盐酸及用酒精洗涤均可以抑制水解,在真空中干燥,不能与空气接触,防止氧化,
故答案为:浓盐酸、95%乙醇、真空干燥;
方法二:(5)利用电解原理制备CuCl,阳极发生氧化反应,Cu失去电子,与氯离子作用生成CuCl,阳极的电极反应式为:Cu-e-+Cl-=CuCl,
故答案为:Cu-e-+Cl-=CuCl;
(6)虽然Ksp(CuCl)远远大于Ksp(CuOH),但阳极区Cl-浓度远远高于OH-的浓度,故开始没有CuOH生成,而是生成CuCl,
故答案为:阳极区Cl-浓度远远高于OH-的浓度.
点评 本题考查实验制备方案,涉及对工艺流程的理解、对操作与试剂的分析评价、平衡移动、电解原理、溶度积应用等,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合溶液中c(Na+ )=6mol/L | B. | 电解后溶液中c(H+)=4mol/L | ||
| C. | 上述电解过程中共转移8mol电子 | D. | 电解后得到的Cu的物质的量为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
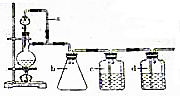 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH2CH=CH2+CO+H2$→_{△}^{催化剂}$CH3CH3CH2CHO$→_{△}^{H_{2}催化剂}$CH3CH2CH2CH2OH.
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH2CH=CH2+CO+H2$→_{△}^{催化剂}$CH3CH3CH2CHO$→_{△}^{H_{2}催化剂}$CH3CH2CH2CH2OH.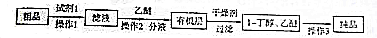
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
. 4NO+6H2O.
4NO+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
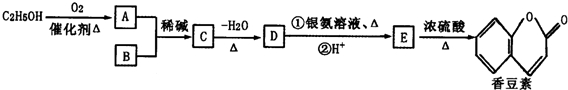
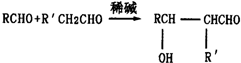 (R、R′为烃基或氢原子)
(R、R′为烃基或氢原子)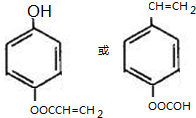 .
.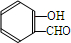 $\stackrel{NaOH}{→}$
$\stackrel{NaOH}{→}$ 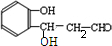 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
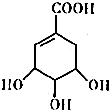 莽草酸的结构简式如图.请回答:
莽草酸的结构简式如图.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com