
分析 可能发生的反应为:4NO2+O2+2H2O=4HNO3,4NO+3O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO,最终剩余的气体可能为NO或O2,然后结合题中数据及反应方程式分别进行计算原混合气体中NO,NO2的体积;
解答 解:将40mL NO和NO2的混和气体,与20mLO2混合,跟水充分反应吸收后,还剩余6mL无色气体,可能发生的反应为:4NO2+O2+2H2O=4HNO3,4NO+3O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO,所以最终剩余的气体可能为:NO或O2,
①当剩余6ml气体为O2时,反应消耗氧气的体积为20mL-6mL=14mL,40ml的NO、NO2混合气体中两种气体的体积分别为x、y,依据4NO2+O2+2H2O=4HNO3,4NO+3O2+2H2O=4HNO3可得$\left\{\begin{array}{l}{x+y=40}\\{\frac{3}{4}x+\frac{1}{4}y=14}\end{array}\right.$,解得x=8ml,y=32ml,
②当剩余气体为NO时,则发生4NO2+O2+2H2O=4HNO3,4NO+3O2+2H2O=4HNO3的NO和NO2=的体积为40-6=34mL,则设34ml中NO、NO2混合气体中两种气体的体积分别为m、n,依据4NO2+O2+2H2O=4HNO3,4NO+3O2+2H2O=4HNO3可得:$\left\{\begin{array}{l}{m+n=34}\\{\frac{3}{4}m+\frac{1}{4}n=20}\end{array}\right.$,解得m=23ml,n=11ml,即:混合气体中NO体积为23+6=29mL、二氧化氮体积为11mL,
答:原混合气体中NO体积为8mL时、二氧化氮体积为32mL或NO为29mL,NO2的体积为11mL.
点评 本题考查了氮氧化物的性质、混合物有关计算,难度中等,关键是分析剩余气体的成分,再根据方程式计算;


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实 实验步骤 | 预期现象与结论 |
| 步步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加再滴加几滴氯水. | 溶 溶液变成黄色,推测有Fe3+或I2生成. |
| 步骤2:向试管中继续滴加几滴20%KSCN溶液或向试管中继续滴加几滴淀粉溶液 | 溶液不变红,说明I-的还原性强于Fe2+或溶液变蓝,说明I-的还原性强于Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2O3和CO2是同素异形体 | B. | C2O3和CO完全燃烧,产物都是CO2 | ||
| C. | C2O3和CO 都是酸性氧化物 | D. | C2O3和CO2都是碳酸的酸酐 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为34,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Y、W位于同主族.
原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为34,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Y、W位于同主族.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② | ||
| ③ | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过量氨水除去AlCl3溶液中的FeCl3 | |
| B. | 用饱和Na2CO3溶液除去CO2中HCl | |
| C. | 用Br2除去KBr溶液中的KCl | |
| D. | 用CuO除去CuCl2中的FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
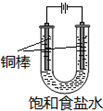 CuCl是应用广泛的有机合成催化剂,可采取不同方法制取.
CuCl是应用广泛的有机合成催化剂,可采取不同方法制取. [CuCl3]2-(无色溶液)逆向移动,生成CuCl.
[CuCl3]2-(无色溶液)逆向移动,生成CuCl.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com