
| A. | 用过量氨水除去AlCl3溶液中的FeCl3 | |
| B. | 用饱和Na2CO3溶液除去CO2中HCl | |
| C. | 用Br2除去KBr溶液中的KCl | |
| D. | 用CuO除去CuCl2中的FeCl3 |
分析 A.二者都与氨水反应生成沉淀;
B.二者都与碳酸钠反应;
C.溴不能除去KCl杂质;
D.CuO用于调节溶液pH,有利于铁离子水解生成氢氧化铁沉淀而除去.
解答 解:A.AlCl3与氨水反应生成氢氧化铝沉淀,可加入氢氧化铝或氧化铝,调节溶液pH,有利于铁离子水解生成氢氧化铁沉淀而除去,故A错误;
B.二氧化碳与碳酸钠反应,应加入饱和碳酸氢钠除杂,故B错误;
C.溴与KCl不反应,不能除去KCl杂质,故C错误;
D.CuO用于调节溶液pH,有利于铁离子水解生成氢氧化铁沉淀而除去,可用于除杂,故D正确.
故选D.
点评 本题考查混合物分离、提纯方法的选择和应用,为高频考点,把握物质的性质及性质差异为解答的关键,侧重除杂的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁与足量氯气完全反应转移的电子数为0.2NA | |
| B. | 100 mL 2.0 mol•L-1的盐酸与醋酸溶液中氢离子均为0.2NA | |
| C. | 标准状况下,22.4 L CO2与22.4 L H2O所含原子数均为3 NA | |
| D. | 体积分别为1.0L pH=2的盐酸与硫酸溶液中氢离子数均为0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:CO2<H2O<SiO2<KCl | B. | 还原性:S2->I->Br->Cl- | ||
| C. | 酸性:H3PO4>H2SO4>HClO4>H2SiO3 | D. | 稳定性:H2O<NH3<PH3<SiH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
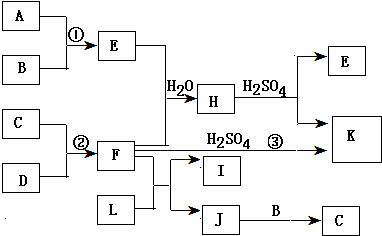
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合溶液中c(Na+ )=6mol/L | B. | 电解后溶液中c(H+)=4mol/L | ||
| C. | 上述电解过程中共转移8mol电子 | D. | 电解后得到的Cu的物质的量为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
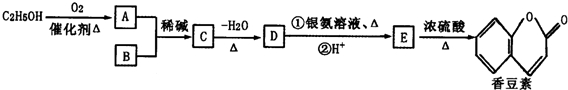
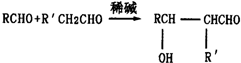 (R、R′为烃基或氢原子)
(R、R′为烃基或氢原子)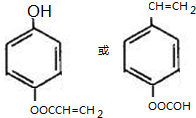 .
.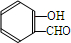 $\stackrel{NaOH}{→}$
$\stackrel{NaOH}{→}$ 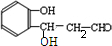 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com