
����Ŀ��NA��ʾ�����ӵ���������ֵ������˵����ȷ����
��3.9g����������H2��Ӧʱ�����뷴Ӧ��̼̼˫����Ϊ0.15NA
��3.1g�����ƺ�3.9g�������ƵĻ�����к��е�����������Ϊ0.1NA
��1.8g14CH4��ˮ����(H216O)�Ļ�������к�������ĿΪNA
�ܳ�����1L0.5mol/LNH4Cl��Һ��2L0.25mol/LNH4Cl��Һ����![]() ����Ŀ��ͬ
����Ŀ��ͬ
�ݳ�����4.6gNO2��N2O4���������������ԭ������Ϊ0.3NA
��1molSiO2�����к��м��Թ��ۼ���ĿΪ2NA
�߽�1molCl2ͨ������ˮ�У���Һ��HClO��Cl��ClO������֮��Ϊ2NA
������£�16.8gFe������ˮ������ȫ��Ӧת�Ƶ�����Ϊ0.8NA
A.�٢ڢܢ�B.�ڢۢݢ�C.�ڢۢޢ�D.�ۢݢߢ�
���𰸡�B
��������
�ٱ�������û��̼̼˫�����ٲ���ȷ��
�������ƺ������Ƶ�����У������������ӵĸ�������ͬ������1:2��3.1g�����ƺ�3.9g�������Ƶ����ʵ�����Ϊ0.05mol���ʻ�����к��е�����������Ϊ0.1NA������ȷ��
��14CH4��ˮ����(H216O)�ķ����ھ���10�����ӣ�14CH4��H216O��Ħ��������ͬ������1.8g14CH4��ˮ����(H216O)�Ļ����������ʵ���Ϊ1mol�����к�������ĿΪNA������ȷ��
������ͬ�¶��£��ε�ˮ��̶���Ũ���������С���ʳ�����1L0.5mol/LNH4Cl��Һ��2L0.25mol/LNH4Cl��Һ����![]() ����Ŀ����ͬ���ܲ���ȷ��
����Ŀ����ͬ���ܲ���ȷ��
��4.6gNO2�����ʵ���Ϊ0.1mol����0.3NA��ԭ�ӡ�NO2��N2O4�����ʽ��ͬ������4.6gNO2��N2O4�������������ԭ��������4.6gNO2����ͬ��Ϊ0.3NA������ȷ��
��SiO2������Si����λ����4������1mol SiO2�����к��м��Թ��ۼ���ĿΪ4NA������ȷ��
��Cl2ͨ������ˮ�У�������Һ�к���Cl2��HClO��Cl-��C1O-�����ӡ��������غ��֪����1molCl2ͨ������ˮ��,��Һ��HClO��Cl-��C1O-������֮��С��2NA���߲���ȷ��
������£�Fe��ˮ������Ӧ������������������16.8gFe(��0.3mol Fe)������ˮ������ȫ��Ӧת�Ƶ�����Ϊ0.8NA������ȷ��
�����������ڢۢݢ���ȷ����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ǽ����ͽ��������Լ���ػ��������Ź㷺��Ӧ�ã��ش�����������⣺
(1)ͭ��ͭ�ε���ɫ��ӦΪ��ɫ�������й�ԭ��������������ȷ����______(����ĸ)��
a. ���Ӵӻ�̬ԾǨ���ϸߵļ���̬ b. ���Ӵӽϸߵļ���̬ԾǨ����̬
c. ��ɫ��Ӧ�Ĺ����������չ��� d. ��ɫ��Ӧ�Ĺ������ڷ������
(2)InԪ�ػ�̬ԭ�ӵļ۵����Ų�ʽΪ________����CuԪ��ͬ���ڣ��һ�̬ԭ����2��δ�ɶԵ��ӵĹ���Ԫ����____(��Ԫ�ط���)��
(3)��һ��������(E1)��Ԫ�صĻ�̬��̬ԭ�ӵõ�һ�������γ���̬��һ������ʱ���ų����������ڶ����ڲ���Ԫ�ص�E1�仯������ͼ��ʾ���Է���̼Ԫ�ص�E1�ϴ��ԭ��______________��
(4)[PtCl4(NH3)2]��H-N-H��֮��ļн�____(����>����<������=��)NH3������H-N-H��֮��ļнǣ�ԭ����________________��
(5)����������CO�����γ��ʻ������Fe(CO)5��Ni(CO)4��1��Fe(CO)5�����к���������ĿΪ____����֪Ni(CO)4����Ϊ�������幹�ͣ������ܼ��ܹ��ܽ�Ni(CO)4����____(����ĸ)��
A. ���Ȼ�̼��������B.�� C.ˮ D.Һ��
(6)Fe3O4�����У�O2-���ظ����з�ʽ��ͼ��ʾ�������з�ʽ�д���������1��3��6��7��O2-Χ�ɵ����������϶����3��6��7��8��9��12��O2-Χ�ɵ����������϶��Fe3O4����һ���Fe3+��������������϶�У���һ��Fe3+��Fe2����������������϶�У���Fe3O4�����У����������϶����O2-��֮��Ϊ____��Fe3O4��������8��ͼʾ�ṹ��Ԫ�������ܶ�Ϊ5.18 g��cm-3����þ�������a=_____cm(д���������ʽ����)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ���������仯�����Ȼ�����ǻ�ѧ��Ӧ�������仯����Ҫ��ʽ֮һ��
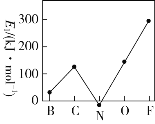
��1����ӦA(g)��B(g)![]() C(g)��D(g)����Ӧ�����������仯����ͼ��ʾ���ش��������⣺
C(g)��D(g)����Ӧ�����������仯����ͼ��ʾ���ش��������⣺

�ٻ�ѧ��Ӧ�в��������仯�ı���ԭ����____________________________________________��
�ڸ÷�Ӧ��_____��Ӧ(����Ȼ���ȡ�)����H��__________ (��E1��E2��ʾ)��
�ۼ�������Ը÷�Ӧ�Ħ�H�Ƿ���Ӱ�죿___________��
��2����֪��2CH3OH(l)��2O2(g)![]() 2CO(g)��4H2O(g) ��H1����a kJmol��1��2CO(g)��O2(g)
2CO(g)��4H2O(g) ��H1����a kJmol��1��2CO(g)��O2(g)![]() 2CO2(g) ��H2����b kJmol��1��H2O(g)
2CO2(g) ��H2����b kJmol��1��H2O(g)![]() H2O(l) ��H3����c kJmol��1�����ʾCH3OH(l)ȼ���ȵ��Ȼ�ѧ����ʽΪ___________________________________________��
H2O(l) ��H3����c kJmol��1�����ʾCH3OH(l)ȼ���ȵ��Ȼ�ѧ����ʽΪ___________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���û�ѧ�����ʾNa2CO3��2Cl2===2NaCl��Cl2O��CO2�е��������������ȷ����(����)
A. Na���Ľṹʾ��ͼ��![]()
B. Cl2O�Ľṹʽ��Cl��O��Cl
C. ����������������3����ԭ�ӣ�3517Cl
D. CO2�ĵ���ʽ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�������Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϣ����úϳ���(��Ҫ�ɷ�ΪCO��CO2��H2)�ڴ��������ºϳɼ״�����������Ҫ��Ӧ���£�
��CO(g)��2H2(g)![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g) ��H2
CH3OH(g)��H2O(g) ��H2
��CO2(g)��H2(g)![]() CO(g)��H2O(g) ��H3
CO(g)��H2O(g) ��H3
��1���ش��������⣺��֪��Ӧ������صĻ�ѧ�������������£�
��ѧ�� | H��H | C��O | C��O | H��O | C��H |
E/(kJ��mol��1) | 436 | 343 | 1 076 | 465 | 413 |
�ɴ˼��㦤H1��______kJ��mol��1����֪��H2����58 kJ��mol��1����H3��_______kJ��mol��1��
(2)��֪�ڳ��³�ѹ�£�
��2CH3OH(l)��3O2(g)===2CO2(g)��4H2O(g) ��H����1 275.6 kJ��mol��1
��H2O(l)===H2O(g) ��H����44.0 kJ��mol��1
д����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽ_________________��
��3����֪����ʱ���ױȰ����ȶ�����֪��
��P4�����ף�s��+5O2��g��===2P2O5��s����H1
��4P�����ף�s��+5O2��g��===2P2O5��s����H2
�ȽϷ�Ӧ�Ц�H�Ĵ�С����H1_______��H2�����������������=������
��4����֪��ϡ��Һ�У�H+��aq��+OH����aq��===H2O��l����H=��57.3 kJ![]() ����Ũ������ϡ����������Һ��Ӧ����1 molˮ���ų�������_____57.3 kJ�����������������=������
����Ũ������ϡ����������Һ��Ӧ����1 molˮ���ų�������_____57.3 kJ�����������������=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ��ѧ��Դ�������õIJ��ֹ�����ͼ��ʾ������˵����ȷ���ǣ� ��
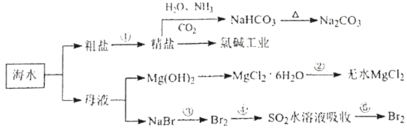
A.�ó����ʯ��ˮ�ɼ���NaHCO3��Na2CO3
B.�Ӻ�ˮ�еõ�������Ҫ��ͨ����������ʵ�ֵ�
C.�ڲ���ۣ��п�ͨ��Cl2ʹ�����ӱ���ԭΪBr2
D.�ڲ�����У�SO2ˮ��Һ����Br2����Һ��pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ե��ʳ��ˮΪ������ȡ�����Ȳ�Ʒ�Ĺ�ҵ��Ϊ���ȼҵ��������Ŀǰ��ѧ��ҵ����Ҫ֧��֮һ��
��1�������ʳ��ˮʱ����NaCl������Ϊ234 g���������������ɵ����������Ϊ________��(��״��)��
��2������2 mol������ͨ������ʯ�����У������Ͽɵõ��������________�ˡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȷ�Ӧ�������ں��Ӹֹ죬���һ�������ұ���۵�ϸߵĽ����緰�������̵ȡ�
����ƽ���������ȷ�Ӧұ�����������ܵĻ�ѧ����ʽ��ָ����Щ�����ǻ�ԭ������Щ������������������������1 mol���ֽ����ֱ���Ҫ������������
V2O5+Al����Al2O3+V Co3O4+Al����Al2O3+Co
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A.��ӦA(g)2B(g) ��H��������Ӧ�Ļ��ΪEa kJ/mol���淴Ӧ�Ļ��ΪEb kJ/mol������H=(Eb-Ea)kJ/mol
B.��ӦCH4(g)+H2O(g)�TCO(g)+3H2(g)��һ�����������Է����У��÷�Ӧһ��Ϊ���ȷ�Ӧ
C.0.1 molL-1 CH3COOH��Һ��ˮϡ�ͣ���Һ��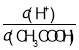 ����
����
D.��⾫��ͭʱ����ͭ����ӵ�Դ�����������������е������Һ�е�c(Cu2+)���ֲ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com