
【题目】铝热反应不仅用于焊接钢轨,而且还常用于冶炼熔点较高的金属如钒、铬、锰等。
请配平下列用铝热反应冶炼金属钒和钴的化学方程式,指出哪些物质是还原剂、哪些物质是氧化剂,并计算生成1 mol各种金属分别需要纯铝的质量。
V2O5+Al——Al2O3+V Co3O4+Al——Al2O3+Co
【答案】3V2O5+10Al![]() 5Al2O3+6V 还原剂:Al 氧化剂:V2O5 生成1 mol V需要纯铝45 g
5Al2O3+6V 还原剂:Al 氧化剂:V2O5 生成1 mol V需要纯铝45 g
3Co3O4+8Al![]() 4Al2O3+9Co 还原剂:Al 氧化剂:Co3O4 生成1 mol Co需要纯铝24 g
4Al2O3+9Co 还原剂:Al 氧化剂:Co3O4 生成1 mol Co需要纯铝24 g
【解析】
根据原子守恒配平化学方程式。两个反应均为氧化还原反应,根据“所含元素化合价升高的物质是还原剂,所含元素化合价降低的物质是氧化剂”进行判断:
3V2O5+10Al![]() 5Al2O3+6V中,V的化合价由+5价降低为0价,作氧化剂,Al的化合价由0价升高到+3价,是还原剂,生成1molV需要
5Al2O3+6V中,V的化合价由+5价降低为0价,作氧化剂,Al的化合价由0价升高到+3价,是还原剂,生成1molV需要![]() mol的Al,所以需要铝的质量为
mol的Al,所以需要铝的质量为![]() mol×27g/mol=45g。
mol×27g/mol=45g。
3Co3O4+8Al![]() 4Al2O3+9Co中,Co的化合价由+
4Al2O3+9Co中,Co的化合价由+![]() 价降低到0价,作氧化剂,Al的化合价由0价升高到+3价,是还原剂,生成1molCo需要
价降低到0价,作氧化剂,Al的化合价由0价升高到+3价,是还原剂,生成1molCo需要![]() mol的Al,所以需要铝的质量为
mol的Al,所以需要铝的质量为![]() mol×27g/mol=24g。
mol×27g/mol=24g。


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】某氧化铁样品中含有少量的硫酸亚铁。某同学要测定其中铁元素的质量分数,设计了如下实验方案。

(1)操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有__________(填仪器名称)。
(2)反应①中加入足量H2O2溶液,反应的离子方程式:_______________________________。
(3)检验沉淀中![]() 是否洗涤干净的操作是_______________________________________。
是否洗涤干净的操作是_______________________________________。
(4)将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是_____________________。
(5)坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为________________。
(6)有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?__________(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用以下装置制备并检验Cl2的性质。下列说法正确的是( )
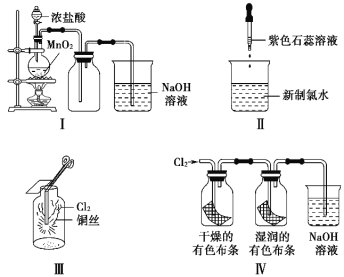
A. Ⅰ图:若MnO2过量,则浓盐酸可全部消耗完
B. Ⅱ图:证明新制氯水只有酸性
C. Ⅲ图:产生了棕黄色的雾
D. Ⅳ图:湿润的有色布条褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是![]() 和
和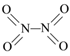 。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式_________________________
(2)对反应N2O4(g)![]() 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是______
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是______
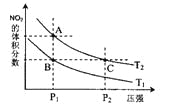
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为_____mol·(L·s)-1。
②n3____n4(填“>”、“<”或“=”),该反应的平衡常数K的值为_____________,升高温度后,反应2NO2![]() N2O4的平衡常数K将_______(填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将_______(填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2
④计算③中条件下达到平衡后混合气体的平均相对分子质量为____________。(结果保留小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铝热反应焊接钢轨的原理是2Al+Fe2O3![]() 2Fe+Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褐色硬块的组成。
2Fe+Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褐色硬块的组成。
(1)将褐色硬块处理成粉末状。研究小组首先排除了含有单质Al杂质的可能性,实验方法是________,证明不含单质铝的现象是_____________。
(2)该褐色硬块的组成基本确定为Fe、Fe2O3,Al2O3。请以上述粉末为样品,验证其组成。限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20% KSCN、3 mol·L-1NaOH、3 mol·L-1HCl、3 mol·L-1HNO3、3 mol·L-1CuSO4、0.01 mol·L-1KMnO4、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。_____________。
实验操作 | 预期现象和结论 |
步骤1: | |
步骤2: | |
步骤3: | |
步骤4: |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功研制出丁苯酞,标志着我国在脑血管疾病治疗药物研究领域达到了国际先进水平。合成丁苯酞(J)的一种路线如下:
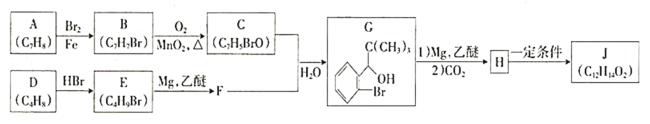
已知:
①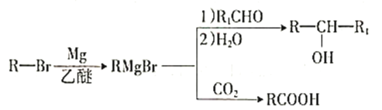
②E的核磁共振氢谱只有一组峰;
③J是一种酯,分子中除苯环外还含有一个五元环。
回答下列问题:
(1)A的化学名称为________,H中官能团的名称为________、________。
(2)由A生成B反应类型为__________________。
(3)由D生成E的化学方程式为__________________。
(4)J的结构简式为________________。
(5)![]() 与CO2反应生成X,X的同分异构体中:
与CO2反应生成X,X的同分异构体中:
①能发生水解反应;②能发生银镜反应;能与氯化铁溶液发生显色反应。
满足上述条件X的同分异构体共有________种(不考虑立体异构),写出核磁共振氢谱有五组峰的同分异构体结构简式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘酸钾常用作食盐加碘剂以防止缺碘疾病,也是常用的基准物质和氧化剂。工业上碘酸钾可用如图所示装置进行制备。下列说法错误的是( )
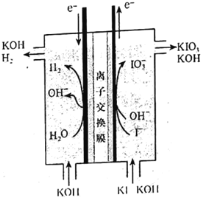
A.其阳极反应式是I-+3H2O-6e-=IO![]() +6H+
+6H+
B.该工业过程中KOH是循环利用的物质
C.制得21.4gKIO3产生标况下H26.72L
D.该工业过程使用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应3A(g)![]() 3B(?)+C(?) △H>0达到化学平衡后,
3B(?)+C(?) △H>0达到化学平衡后,
(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。
a.若B、C都是气体,气体的平均相对分子质量①___;
b.若B、C都不是气体,气体的平均相对分子质量②____;
c.若B是气体,C不是气体,气体的平均相对分子质量③___;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是④___态,C是⑤___态。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1mol·L-1 FeSO4溶液:Na+、K+、Cl-、MnO![]()
B.0.1mol·L-1 NaOH溶液:Na+、K+、CO![]() 、AlO
、AlO![]()
C.0.1mol·L-1 Ba(OH)2溶液:K+、NH![]() 、NO
、NO![]() 、HSO
、HSO![]()
D.加入铁粉放出氢气的溶液:NH![]() 、Fe3+、ClO-、SO
、Fe3+、ClO-、SO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com