
【题目】碘酸钾常用作食盐加碘剂以防止缺碘疾病,也是常用的基准物质和氧化剂。工业上碘酸钾可用如图所示装置进行制备。下列说法错误的是( )
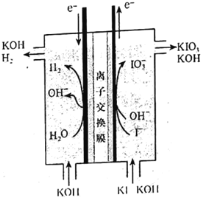
A.其阳极反应式是I-+3H2O-6e-=IO![]() +6H+
+6H+
B.该工业过程中KOH是循环利用的物质
C.制得21.4gKIO3产生标况下H26.72L
D.该工业过程使用阳离子交换膜
【答案】A
【解析】
该装置为电解池装置,根据电子流向可知左侧为阴极,水电离出的氢离子得电子生成氢气,右侧为阳极,碘离子失电子生成碘酸根。
A.右侧为阳极,电解质溶液显碱性,所以碘离子失电子再和氢氧根作用生成碘酸根,电极方程式为Iˉ+6OHˉ-6e-=IO![]() +3H2O,故A错误;
+3H2O,故A错误;
B.该装置左侧阴极上水电离出的氢离子放电生成氢气,同时产生OHˉ,右侧电解质中溶液中钾离子通过离子交换膜进入阴极,所以阴极产物为氢气和KOH,阳极消耗KOH,所以该工业过程中KOH是循环利用的物质,故B正确;
C.21.4gKIO3的物质的量为![]() =0.1mol,I元素化合价由-1价变为+5价,化合价升高6价,所以生成0.1mol碘酸钾时转移0.6mol电子,根据电子守恒可知此时阴极生成0.3mol氢气,标况下体积为6.72L,故C正确;
=0.1mol,I元素化合价由-1价变为+5价,化合价升高6价,所以生成0.1mol碘酸钾时转移0.6mol电子,根据电子守恒可知此时阴极生成0.3mol氢气,标况下体积为6.72L,故C正确;
D.该装置左侧阴极上水电离出的氢离子放电生成氢气,同时产生OHˉ,为了使右侧产生的碘酸钾更纯,需要防止氢氧根进入阳极,同时右侧电解质中溶液中钾离子需要通过离子交换膜进入阴极,所以离子交换膜为阳离子交换膜,故D正确;
故答案为A。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】常温时,100 mL 0.10 mol·L-1 H2A溶液用0.10 mol·L-1NaOH溶液滴定,滴定曲线如图所示。已知:p![]() = -lg
= -lg![]() 。下列说法不正确的是
。下列说法不正确的是

A.水的电离程度:Y>X>W
B.NaHA溶液呈酸性
C.反应H2A+A2- ![]() 2HA-的平衡常数K=105.6
2HA-的平衡常数K=105.6
D.Y点溶液中:c (Na+)=c (OH-)+3c (HA-)-c (H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]环丙贝特(H)是一种降血脂药物,可明显降低极低密度和低密度脂蛋白水平,并升高高密度脂蛋白,通过改善胆固醇的分布,可减少CH和LDL在血管壁的沉积,还有溶解纤维蛋白和阻止血小板凝聚作用。如图是合成环丙贝特的一种新方法:
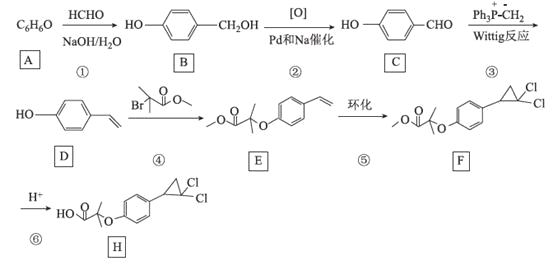
回答下列问题:
(1)C的化学名称为______________________
(2)F中含氧官能团的名称为______________
(3)H的分子式为________________________
(4)反应①的反应类型为___________,反应④的化学方程式为______________________
(5)M为![]() 的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
(6)利用Wittig反应,设计以环己烷为原料(其他试剂任选),制备![]() 的合成路线:______________________。
的合成路线:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应不仅用于焊接钢轨,而且还常用于冶炼熔点较高的金属如钒、铬、锰等。
请配平下列用铝热反应冶炼金属钒和钴的化学方程式,指出哪些物质是还原剂、哪些物质是氧化剂,并计算生成1 mol各种金属分别需要纯铝的质量。
V2O5+Al——Al2O3+V Co3O4+Al——Al2O3+Co
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,属于吸热反应的是( )
①液态水的汽化 ②将胆矾加热变为白色粉末
③浓硫酸稀释 ④KCl03分解制氧气
⑤生石灰跟水反应生成熟石灰
⑥CaCO3高温分解⑦CO2+C![]() 2CO
2CO
⑧Ba(OH)2·8H2O与固体NH4Cl混合
⑨C(s)+H2O(g)![]() CO(g)+H2(g)⑩Al与盐酸反应
CO(g)+H2(g)⑩Al与盐酸反应
A. ②③④⑤⑥⑦⑧⑨ B.②④⑥⑦⑧⑨ C.②④⑥⑧ D.②③④⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌在电池制造方面有着重要的作用,也是人体必需的微量元素之一。它与常见的非金属都可以形成重要的化合物。
(1)Zn的核外电子排布式是[Ar]___。
(2)Zn的各级电离能数据如下表所示:

①请依据表中数据说明锌的常见化合价为+2的原因是___。
②氧、硫、氯三种常见非金属的电负性,由大到小的顺序是___。二氯化硫为鲜红色液体,熔点-78℃,则其晶体中微粒间的作用力应属于___,它的分子中中心原子具有的孤电子对数是___。
(3)氯化锌易溶于水,在水中形成配合物H[ZnCl2(OH)],H[ZnCl2(OH)]在水中电离时的离子方程式为___。
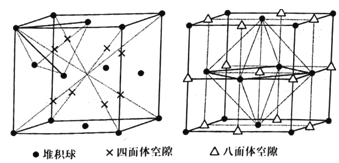
(4)晶胞的空隙问题是晶胞研究的重要内容。
①已知面心立方晶胞的四面体空隙和八面体空隙状况如图所示。面心立方晶胞的每个晶胞中,堆积球数:四面体空隙数:八面体空隙数=___。
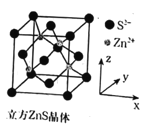
②根据立方ZnS晶胞示意图,描述在每个晶胞中,锌离子填充在硫离子的立方面心晶胞空隙中的方式为___。离坐标参数为(0,0,0)的硫离子最近的锌离子坐标参数为___ (参数数值限定为正值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。
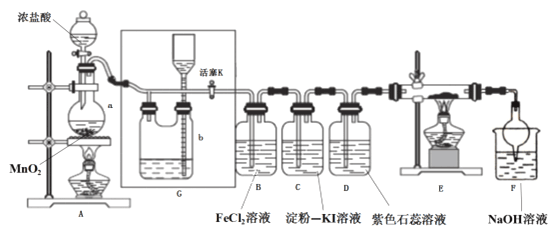
(1)A中发生反应的化学反应方程式为________
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
①在装置C、D中能看到的实验现象分别是 ________ 、________;
②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为_________;
③装置F中球形干燥管的作用是__________;
(3)储气瓶b内盛放的试剂是___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
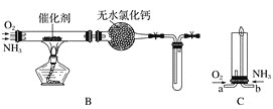
【题目】资料显示:“氨气可在纯氧中安静燃烧……”。某校化学兴趣小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验对比。
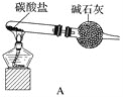
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是____________________;碱石灰的作用是__________________________。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式__________________;试管内气体变为红棕色,该反应的化学方程式是_______________________。
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请说明可能的原因________________________。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气生成氮气和水:
①两气体通入的先后顺序是_____________,其理由是______________________。
②氨气燃烧的化学方程式是_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
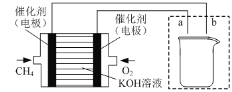
【题目】钢铁是用途最广泛的金属材料。
(1)将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。写出正极反应式:______。

(2)纯铁作电极插入浓的NaOH溶液电解可制得Na2FeO4,装置如图所示。阳极的电极反应式为______;若消耗11.2g铁,则通过离子交换膜的Na+物质的量为______。

(3)如图所示装置为利用甲烷燃料电池实现在铁质材料上镀锌的一部分,燃料电池的负极反应式为______;在如图所示虚线框内补充完整在铁质材料上镀锌的装置图(注明电极材料和电解质溶液的成分)。_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com