
【题目】钢铁是用途最广泛的金属材料。
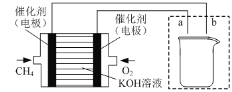
(1)将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。写出正极反应式:______。

(2)纯铁作电极插入浓的NaOH溶液电解可制得Na2FeO4,装置如图所示。阳极的电极反应式为______;若消耗11.2g铁,则通过离子交换膜的Na+物质的量为______。

(3)如图所示装置为利用甲烷燃料电池实现在铁质材料上镀锌的一部分,燃料电池的负极反应式为______;在如图所示虚线框内补充完整在铁质材料上镀锌的装置图(注明电极材料和电解质溶液的成分)。_____
【答案】O2+4e-+2H2O=4OH- Fe+8OH--6e-=FeO![]() +4H2O 1.2mol CH4-8e-+10OH-=CO
+4H2O 1.2mol CH4-8e-+10OH-=CO![]() +7H2O
+7H2O 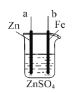
【解析】
(1)铁粉、活性炭和NaCl溶液构成了原电池,发生吸氧腐蚀;
(2)纯铁作电极插入浓的NaOH溶液电解可制得Na2FeO4,铁元素化合价身高,被氧化,则铁作阳极,被氧化得到高铁酸根FeO42-;当消耗1mol铁时,阳极室减少6mol负电荷,则为平衡电荷,会有6molNa+通过离子交换膜移动向阴极;
(3)甲烷燃料电池为碱性环境,甲烷在负极失电子被氧化得到碳酸根;通甲烷的一极为负极,通氧气的一极为正极,电解池中连接电源正极的为阳极,连接电源负极的为阴极,在铁质材料上镀锌时,锌作阳极,铁作阴极,据此解答。
(1)铁粉、活性炭和NaCl溶液构成了原电池,发生吸氧腐蚀,O2在正极得电子发生还原反应,正极反应式为:O2+4e-+2H2O=4OH-;
(2)纯铁作电极插入浓的NaOH溶液电解可制得Na2FeO4,铁元素化合价身高,被氧化,则铁作阳极,阳极的电极反应式为Fe+8OH--6e-=FeO![]() +4H2O,根据电极反应式知,当消耗1mol铁时,阳极室减少6mol负电荷,则为平衡电荷,会有6mol Na+通过离子交换膜移动向阴极;若消耗11.2g铁,即0.2mol铁,则通过离子交换膜的Na+物质的量为1.2mol;
+4H2O,根据电极反应式知,当消耗1mol铁时,阳极室减少6mol负电荷,则为平衡电荷,会有6mol Na+通过离子交换膜移动向阴极;若消耗11.2g铁,即0.2mol铁,则通过离子交换膜的Na+物质的量为1.2mol;
(3)甲烷燃料电池为碱性环境,甲烷在负极失电子被氧化得到碳酸根,负极反应式为CH4-8e-+10OH-=CO32-+7H2O;通甲烷的一极为负极,通氧气的一极为正极,则在电解池中a为阳极,b为阴极,在铁质材料上镀锌时,锌作阳极,铁作阴极,则a为锌电极,b为铁电极,电解质溶液可以是硫酸锌、氯化锌等锌的可溶性盐溶液,则装置图为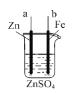 。
。


科目:高中化学 来源: 题型:
【题目】碘酸钾常用作食盐加碘剂以防止缺碘疾病,也是常用的基准物质和氧化剂。工业上碘酸钾可用如图所示装置进行制备。下列说法错误的是( )
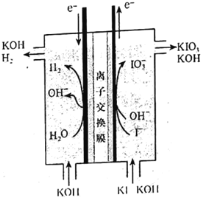
A.其阳极反应式是I-+3H2O-6e-=IO![]() +6H+
+6H+
B.该工业过程中KOH是循环利用的物质
C.制得21.4gKIO3产生标况下H26.72L
D.该工业过程使用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中的一部分,列出10种元素在元素周期表中的位置.用化学符号回答下列各问题.
周期 |
|
|
|
|
|
|
| 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)10种元素中,化学性质最不活泼的是_________.
(2)①、③、⑤三种元素最高价氧化物对应水化物中,碱性最强的是_________.
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是_________.
(4)元素⑦的简单氢化物的化学式为_____;若该氢化物和元素⑨的单质反应,则化学方程式为_______.
(5)⑤和⑨的最高价氧化物对应水化物的化学式分别为_________和_________.
(6)①和⑤最高价氧化物对应水化物相互反应的离子方程式为__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1mol·L-1 FeSO4溶液:Na+、K+、Cl-、MnO![]()
B.0.1mol·L-1 NaOH溶液:Na+、K+、CO![]() 、AlO
、AlO![]()
C.0.1mol·L-1 Ba(OH)2溶液:K+、NH![]() 、NO
、NO![]() 、HSO
、HSO![]()
D.加入铁粉放出氢气的溶液:NH![]() 、Fe3+、ClO-、SO
、Fe3+、ClO-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种天然化合物X的结构简式如图所示。下列有关该化合物的说法中正确的是

A.化合物X分子中所有原子可能在同一平面上
B.化合物X能使酸性高锰酸钾溶液褪色
C.化合物X存在顺反异构和手性异构
D.X能与NaHCO3溶液反应生成CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电镀锡渣(主要含![]() 、
、![]() )联合生产氯化亚锡和硫酸亚锡晶体,其工艺流程如下:
)联合生产氯化亚锡和硫酸亚锡晶体,其工艺流程如下:

已知:①![]() 易水解生成碱式氯化亚锡
易水解生成碱式氯化亚锡![]() ;②在水溶液中,
;②在水溶液中,![]() 易被氧化为
易被氧化为![]() 。
。
请回答下列问题:
(1)锡在周期表中的位置为___________。
(2)已知反应I得到的沉淀是![]() ,产生气体的结构式为_____,反应的化学方程式为_______。
,产生气体的结构式为_____,反应的化学方程式为_______。
(3)图中滤液的主要成分为_______________、_______________(写化学式)。
(4)酸溶时一般加入浓盐酸进行溶解,请用化学方程式及必要文字解释原因:______________。
(5)电镀锡渣中的锡与烧碱、硝酸钠溶液反应可生产锡酸钠,并产生一种碱性气体,该反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
A.![]() 的过氧化氢溶液中氧原子数为
的过氧化氢溶液中氧原子数为![]()
B.通过核反应![]() 生成
生成![]() 镆,同时产生中子数为
镆,同时产生中子数为![]()
C.常温常压下,![]() 由
由![]() 与
与![]() 组成的混合物中含有的质子总数为
组成的混合物中含有的质子总数为![]()
D.![]() 雄黄(
雄黄(![]() ,
,![]() )中含有
)中含有![]() 个共价键
个共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
A.常温常压下,32 g氧气所含的原子数为NA
B.标准状况下,22.4 L 四氯化碳的分子数为NA
C.0℃,101 kPa下,44.8 L氮气所含有的分子数为2NA
D.常温常压下,1 mol氦气含有的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以左右自由滑动的隔板(其质量忽略不计).其中能表示相同温度时,等质量的氢气与氦气的是( )
A. B.
B.
C. D.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com