
【题目】某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。
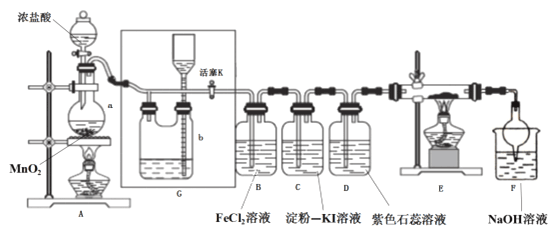
(1)A中发生反应的化学反应方程式为________
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
①在装置C、D中能看到的实验现象分别是 ________ 、________;
②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为_________;
③装置F中球形干燥管的作用是__________;
(3)储气瓶b内盛放的试剂是___________;
【答案】MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑ 溶液由无色变为蓝色 溶液先变红后褪色 C+2Cl2+2H2O
MnCl2+2H2O+Cl2↑ 溶液由无色变为蓝色 溶液先变红后褪色 C+2Cl2+2H2O ![]() CO2+4HCl 防倒吸 饱和NaCl溶液
CO2+4HCl 防倒吸 饱和NaCl溶液
【解析】
本题主要考察实验室制氯气及氯气的化学性质检验。
(1)MnO2和浓HCl反应条件为加热,二氧化锰将HCl氧化为氯气,自身被还原成Mn2+,化学方程式为MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑。
MnCl2+2H2O+Cl2↑。
(2)①C中,氯气具有强氧化性,通入淀粉-KI溶液,发生氧化还原反应,即Cl2+2KI=I2+2KCl,生成的碘单质能够让淀粉溶液变蓝,即现象为溶液由无色变为蓝色;D中,氯气通入到紫色石蕊溶液中,氯气会和水发生反应,即Cl2+H2O=HCl+HClO,其中HCl会使石蕊变红,但HClO具有强氧化性,使变红的溶液褪色,即现象为溶液先变红后褪色。
②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,氯气通过碳粉能够生成HCl,说明反应物中有水参与,根据守恒法,化学方程式为C+2Cl2+2H2O ![]() CO2+4HCl。
CO2+4HCl。
③氯气和氢氧化钠发生反应,导致装置内气压减小,在大气压作用下溶液会被吸到导管中,为防止溶液持续上升,用如图所示装置,使其受到的重力大于大气压作用,从而不能持续上升,故作用为防倒吸。
(3)浓盐酸具有挥发性,刚制得的氯气中混有HCl和水,饱和食盐水吸收HCl而难吸收氯气,故用饱和食盐水除去氯气中的HCl。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】酸雨形成的原理之一可表示如下,请回答下列问题。
![]()
(1)A的化学式为__________,B的化学式为_________。
(2)三个反应中,不属于氧化还原反应的是________(填序号)。
(3)SO2中硫元素显+4价,它可以降低到0价,利用这一性质可在工厂的烟道气中通入合适的________(填“氧化剂”或“还原剂”)除去SO2,达到减少污染的目的。
(4)已知pH=-lgc(H+),经测定某次雨水所含酸性物质只有硫酸,且其浓度为5×10-5mol·L-1,则这次降雨________(填“是”或“不是”)酸雨。
(5)为了除去有害的SO2气体,在英国进行了一个研究,结果表明:高烟囱可以有效降低地面SO2的浓度。在20世纪60年代到70年代,由发电厂排放的SO2增加了35%,但由于高烟囱的建造,地面SO2浓度降低了30%之多。
①你认为减少酸雨产生可采取的措施是__________(填字母)。
A.少用煤作燃料 B.把工厂的烟囱建高
C.燃料脱硫 D.把工厂迁移到农村 E.开发新能源
②请从全球环境保护的角度,分析这种建高烟囱的方法是否可取?________(填“可取”或“不可取”),理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为____________,该元素的符号是________。
(2)Y元素原子的价层电子的轨道表示式为___________,该元素的名称是________。
(3)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是________。
(4)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性并说明理由______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A.54 g Al与足量稀硫酸反应,转移的电子数为6 NA
B.标准状况下,1.8 g H2O所占的体积约为2.24 L
C.物质的量浓度为0.5 mol·L-1的MgCl2溶液中,含有Cl-个数为NA
D.1 mol铁与足量的氯气反应,失去的电子数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子的能力越强,在所形成的分子中成为负电荷一方。
下面是某些短周期元素的x值:
元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析x值变化规律,确定Mg的x值范围:____<x(Mg)< _____。
(2)推测x值与原子半径的关系是____;根据短周期元素的x值变化特点,体现了元素性质的________变化规律。
(3)某有机化合物结构式为![]() ,其中S—N中,你认为共用电子对偏向谁?__(写原子名称)。
,其中S—N中,你认为共用电子对偏向谁?__(写原子名称)。
(4)经验规律告诉我们:当成键的两原子相应元素的差值(Δx),当Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键类型是______。
(5)预测元素周期表中,x值最小的元素位置:_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是生物体细胞内部分有机化合物的概念图,请回答下列问题。

(1)小麦种子中的储能物质c是________,人和动物细胞中的储能物质c是________。
(2)组成b的多肽是由氨基酸通过脱水缩合连接而成,脱水缩合是指____________________。
(3)用洋葱鳞片叶______(填“内”或“外”)表细胞,可以通过染色来观察DNA和e的分布,实验操作步骤中要用盐酸水解,目的有改变细胞膜的通透性,加速染色剂进入细胞,同时使______________________,利于DNA与染色剂结合。
(4)人体摄入的d中_______参与血液中脂质的运输,维生素D能有效地促进__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入足量NaOH溶液,充分反应后消耗 a mol NaOH ,另取一份加入足量盐酸,充分反应后消耗b mol HCl,则该混合溶液中c(Na+)为 ( ) (已知:NaHCO3 + NaOH = Na2CO3 + H2O)
A.(![]() )mol/LB.(
)mol/LB.(![]() )mol/L
)mol/L
C.(10b-5a) mol/LD.(2b-a) mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别燃烧等物质的量的下列各组物质,其中消耗氧气的量相等的是( )
①C2H2与C2H4O ②C4H8与C6H12O6 ③C7H8与C6H12 ④HCOOCH3与CH3COOH.
A.①③④ B.①②③④ C.①④ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如图。
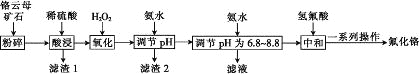
表中列出了相关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 | Fe(OH)2 |
开始沉淀的pH | 2.3 | 8.8 | 4.9 | 7.5 |
沉淀完全的pH | 4.1 | 10.4 | 6.8 | 9.7 |
请回答下列问题:
(1)Fe2O3、MgO、FeO、SiO2中属于碱性氧化物的有________种。
(2)将铬云母矿石粉碎的目的是________。
(3)滤渣1主要成分的用途是________。(写一种)
(4)Cr2O3与稀硫酸反应的化学方程式为___________。
(5)第一次滴加氨水调节pH范围为________。
(6)第二次滴加氨水调节pH为6.8~8.8的目的是_______,Cr(OH)3与 Al(OH)3一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com