
【题目】不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子的能力越强,在所形成的分子中成为负电荷一方。
下面是某些短周期元素的x值:
元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析x值变化规律,确定Mg的x值范围:____<x(Mg)< _____。
(2)推测x值与原子半径的关系是____;根据短周期元素的x值变化特点,体现了元素性质的________变化规律。
(3)某有机化合物结构式为![]() ,其中S—N中,你认为共用电子对偏向谁?__(写原子名称)。
,其中S—N中,你认为共用电子对偏向谁?__(写原子名称)。
(4)经验规律告诉我们:当成键的两原子相应元素的差值(Δx),当Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键类型是______。
(5)预测元素周期表中,x值最小的元素位置:_________
【答案】0.93 1.57 同周期(或同主族)元素,x值越大,原子半径越小 周期性 氮 共价键 第六周期第ⅠA族
【解析】
(1)(2)题中给出的x值与其原子在分子中吸引电子的能力有关,可根据元素周期性变化来推测Mg和N的x值,以表中数值可看出,同周期中元素的x值随原子半径的减小而增大,同主族自上而下x值减小,x值的变化体现周期性的变化;
(3)对比周期表中对角线位置的X值可知:X(B)>X(Si),X(C)>X(P),X(O)>X(Cl),则可推知:X(N)>X(S);
(4)计算Al、Cl的△x值进行判断;
(5)根据x值的递变规律判断。
(1)由表中数值可看出,同周期中元素的x值随原子半径的减小而增大,同主族自上而下x值减小,x值的变化体现周期性的变化,故:0.93<x(Mg)<1.57,故答案为:0.93;1.57;
(2)由表中数值可看出,同周期中元素的x值随原子半径的减小而增大,同主族自上而下原子半径增大,而x值减小,体现了元素性质的周期性变化,故答案为:同周期(或同主族)元素,x值越大,原子半径越小;周期性
(3)对比周期表中对角线位置的X值可知:X(B)>X(Si),X(C)>X(P),X(O)>X(Cl),则可推知:X(N)>X(S),所以SN中,共用电子对应偏向氮原子,故答案为:氮;
(4)查表知:AlCl3的△X=1.55<1.7,又X(Br)<X(Cl),所以AlBr3的△X应小于AlCl3的,为共价键,故答案为:共价键;
(5)根据递变规律,X值最小的应为Cs(Fr为放射性元素)位于第六周期、第ⅠA族,故答案为:第六周期第ⅠA族。


科目:高中化学 来源: 题型:
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4=FeSO4+CuB.3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
C.AgNO3+NaCl=AgCl↓+NaNO3D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素的原子序数依次递增。已知:①F的原子序数为29,其余的均为短周期主族元素;②E原子价电子(外围电子)排布为msnmpn-1;③D原子最外层电子数为偶数;④A、C原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)下列叙述正确的是________(填序号)。
A.金属键的强弱:D>E
B.基态原子第一电离能:D>E
C.五种元素中,电负性最大的元素是E
D.晶格能:NaCl<DCl2
(2)F基态原子的核外电子排布式为_____;与F同一周期的副族元素的基态原子中最外层电子数与F原子相同的元素为_____(填元素符号)。
(3)E单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
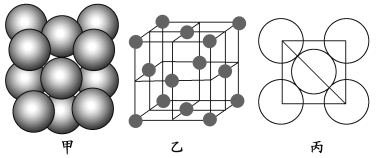
若已知E的原子半径为d,NA代表阿伏加德罗常数,E的相对原子质量为Mr,则一个晶胞中E原子的数目为________,该晶体的密度为_______________ (用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室测定青蒿素(只含C、H、O元素)中氧元素质量分数的实验装置如图所示,下列实验操作或叙述正确的是

A.D装置的目的仅是氧化青蒿素分解的氢气,使之完全转化为水
B.E、F中分别加入的是碱石灰和P2O5
C.确定氧元素的质量分数,需要的数据是实验前后装置C、E、F的质量变化
D.该实验的不足之处仅仅是F之后没有接盛有碱石灰的干燥管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种元素,已知B原子序数大于A,A与B质子数之和为27,质子数之差为5,0.9gC单质与足量盐酸作用 放出标态下1.12 L氢气,同时生成C的三氯化物,回答下列问题:
(1)C的元素符号是________________。
(2)A的原子结构示意图________。
(3)B的氢化物的电子式____________。
(4)排出三种元素最高价氧化物对应的水化物酸碱性由强到弱的顺序_____。
(5)A和C两种元素最高价氧化物对应的水化物反应的离子方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。
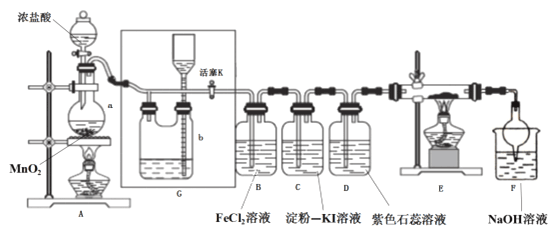
(1)A中发生反应的化学反应方程式为________
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
①在装置C、D中能看到的实验现象分别是 ________ 、________;
②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为_________;
③装置F中球形干燥管的作用是__________;
(3)储气瓶b内盛放的试剂是___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发射“神舟七号”载人飞船的是我国自行研制的“长征一号D”运载火箭。该火箭的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:R+2N2O4=3N2+4H2O+2CO2,下列叙述错误的是( )
A.此反应是氧化还原反应B.该反应产物均为非电解质
C.R的分子式为![]() D.反应瞬间产生大量高温气体,推动火箭飞行
D.反应瞬间产生大量高温气体,推动火箭飞行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钠-过氧化氢加合物的化学式可表示为xNa2SO4·yH2O2·zH2O, (其中x、y、z为各成分物质的量的最简整数比),其化学式可通过下列实验测定:
①准确称取 8.850g 样品,配制成 250mL 溶液A;
②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液,反应至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体1.165g ;
③准确量取25.00mL溶液A,加入适量稀硫酸酸化后,用0.02000 mol·L-1 KMnO4溶液与H2O2反应,消耗0.0010 mol KMnO4。 H2O2与KMnO4反应的方程式如下:
2KMnO4+5H2O2+3H2SO4 =2MnSO4+5O2↑+ K2SO4+8H2O
计算 8.850 g 样品中:
(1)Na2SO4的物质的量为___________________
(2)H2O2的物质的量为________________
(3)该硫酸钠-过氧化氢加合物的化学式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬季我国北方大部分地区出现雾霾天气,引起雾霾的微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物、扬尘、重金属铜等。
(1)N元素原子核外电子云的形状有___________种;基态铜原子的价电子排布式为___________。
(2)N和O中第一电离能较小的元素是___________;SO42-的空间构型___________。
(3)雾霾中含有少量的水,组成水的氢元素和氧元素也能形成化合物H2O2,其中心原子的杂化轨道类型为_________,H2O2难溶于CC14,其原因为___________________。
(4)PM2.5富含NO,NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为________。
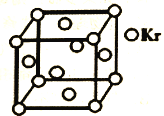
(5)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设NA为阿伏伽德罗常数的值,晶胞边长为540pm,则该晶体的密度_____ g/cm3(只列式不计算,Kr摩尔质量为85g·mol—1)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com