
【题目】酸雨形成的原理之一可表示如下,请回答下列问题。
![]()
(1)A的化学式为__________,B的化学式为_________。
(2)三个反应中,不属于氧化还原反应的是________(填序号)。
(3)SO2中硫元素显+4价,它可以降低到0价,利用这一性质可在工厂的烟道气中通入合适的________(填“氧化剂”或“还原剂”)除去SO2,达到减少污染的目的。
(4)已知pH=-lgc(H+),经测定某次雨水所含酸性物质只有硫酸,且其浓度为5×10-5mol·L-1,则这次降雨________(填“是”或“不是”)酸雨。
(5)为了除去有害的SO2气体,在英国进行了一个研究,结果表明:高烟囱可以有效降低地面SO2的浓度。在20世纪60年代到70年代,由发电厂排放的SO2增加了35%,但由于高烟囱的建造,地面SO2浓度降低了30%之多。
①你认为减少酸雨产生可采取的措施是__________(填字母)。
A.少用煤作燃料 B.把工厂的烟囱建高
C.燃料脱硫 D.把工厂迁移到农村 E.开发新能源
②请从全球环境保护的角度,分析这种建高烟囱的方法是否可取?________(填“可取”或“不可取”),理由是__________。
【答案】SO2 SO3 ③ 还原剂 是 ACE 不可取 未减少二氧化硫的总排
【解析】
(1)酸雨形成是含硫物质的燃烧生成的二氧化硫形成的,依据流程分析可知含硫燃气主要是二氧化硫,催化氧化为三氧化硫,三氧化硫溶于水生成硫酸,反应的过程为:SO2![]() H2SO4;
H2SO4;
故答案为:SO2,SO3;
(2)含硫燃料![]() SO2
SO2![]() H2SO4;反应过程中反应①②反应过程中有元素化合价的变化,属于氧化还原反应,反应③是三氧化硫和水反应生成硫酸,反应过程中无元素化合价变化;
H2SO4;反应过程中反应①②反应过程中有元素化合价的变化,属于氧化还原反应,反应③是三氧化硫和水反应生成硫酸,反应过程中无元素化合价变化;
故答案为:③;
(3)SO2中硫元素显+4价,它可能降低到0价,硫元素化合价降低,做氧化剂,依据氧化还原反应,需要加入还原剂实现转化;
故答案为:还原剂;
(4)硫酸浓度为5×10-5mol/L,c(H+)=2×5×10-5mol/L=10-4则pH=-lgc(H+)=4,小于5.6,所以属于酸雨,
故答案为:是;
(5)Ⅰ、A、减少煤作燃料、C、燃料脱硫、E、开发新能源都可减少含硫物质的排放,可减少二氧化硫的形成,而B、把工厂的烟囱建高不能减少二氧化硫、氮氧化物的产生,即不能减缓酸雨污染,D、把工厂迁移到农村,但不能减缓酸雨污染,
故选ACE;
Ⅱ、把工厂的烟囱建高不能减少二氧化硫、氮氧化物的产生,并且污染的范围更大,
故答案为:不可取;不能减少二氧化硫、氮氧化物的总排放量


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
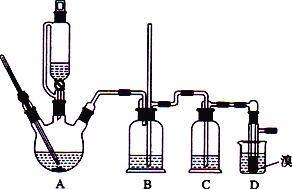
【题目】实验室用CH3CH2OH分两步制备1,2-二溴乙烷现用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
有关数据列表如下:
物质名称 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g·cm-3) | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)装置A中发生的化学方程式为_________________________________,反应类型为________,在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是________(填字母)。
a 引发反应 b减少副产物乙醚生成 c 防止乙醇挥发 d加快反应速率
(2)在装置C中应加入________(填字母),其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3) 装置D中实验现象为_______________。
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在________(填“上”或“下”)层。
(5)反应过程中应用冷水冷却装置D,其主要目的是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试管是化学实验中最常用的玻璃仪器,对试管加热时,下列操作正确的是( )
A.试管外壁有水珠不一定要擦干,加热时会自然挥发
B.应握紧试管夹,大拇指按在短柄上
C.试管中液体的量不能超过试管容积的1/3
D.可以使试管的受热部位在火焰上方先上下移动,后集中加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 1L水中溶解了58.5gNaCl,该溶液的物质的量浓度为1mol/L
B. 从1L 2mol/L的H2SO4溶液中取出0.5L,该溶液的浓度为1mol/L
C. 配制500mL 0.1mol/L的CuSO4溶液,需8.0g硫酸铜固体
D. 0.1mol/L MgCl2溶液中Cl-物质的量为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4=FeSO4+CuB.3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
C.AgNO3+NaCl=AgCl↓+NaNO3D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
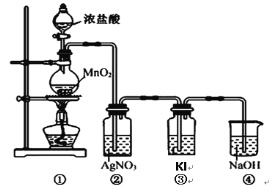
【题目】某兴趣小组利用下列装置,进行与氯气相关的实验。
请回答:
(1)写出实验室用上述方法制取氯气的化学方程式_________。
(2)利用该原理和装置①进行实验,制得的氯气中往往含有的杂质可依次通入到_________、_________除去。
(3)装置②中出现白色沉淀,据此现象能否推测装置①中生成Cl2_________(填“能”或者“否”),请说明理由_________。
(4)实验室从海带中提取碘的就是利用装置③的原理,请写出该溶液中发生反应的离子反应方程式_________。
(5)图中④所示的溶液是为了减少对环境的污染,请写出该溶液中发生反应的离子反应方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由NaCl和BaCl2组成的混合溶液100 mL,分为两等份,向其中一份中加入50mL 0.60 mol·L-1的AgNO3溶液可使溶液中的Cl-沉淀完全;向另一份溶液中加入50 mL 0.20 mol·L-1的稀硫酸可使Ba2+刚好沉淀完全。则原溶液中c(Na+)(单位:mol·L-1)为( )
A. 0.1 B. 0.2 C. 0.4 D. 0.02
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成单质和化合物最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)C原子的价电子轨道表达式为______________________。
(2)碳元素是组成有机物必不可少的元素。1828年,化学家维勒首次用加热的方法将无机物氰酸铵[NH4(OCN)]转化为有机物尿素,开启了人造有机物的大门。氰酸铵中阳离子的立体构型是___________。有机物M( )在一定条件下生成N(
)在一定条件下生成N( )
)
①沸点:M___________N(填“大于”或“小于”)。
②M中碳原子的杂化类型为___________,不同杂化类型的碳原子数之比为___________。
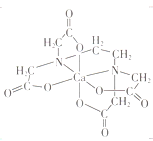
(3)碳的有机物常作为金属有机化合物的配体,如EDTA(乙二胺四乙酸)。EDTA与Ca2+形成的配离子如图所示。该配离子的配位数是___________,配体中碳原子的杂化方式有_________。
(4)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图所示,图中用实线标出了石墨的一个六方晶胞。

①石墨中C原子上未参与杂化的所有p轨道相互平行且重叠,使p轨道中的电子可在整个碳原子平面中运动而导电。六方氮化硼(BN)与石墨晶体结构类似,硼原子和氮原子交替相连,而六方BN却无法导电,其原因是___________。
②晶胞有两个基本要素:石墨一种晶胞结构和部分晶胞参数如图。

a.原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B的坐标参数分别为A(0,0,0)、B(0,1,![]() ),则C原子的坐标参数为___________。
),则C原子的坐标参数为___________。
b. 晶胞参数用以描述晶胞的大小和形状。已知石墨晶胞底边长为acm,层间距为 d cm,阿伏加德罗常数的值为NA,则石墨的密度为___________g·cm-3(写出表达式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。
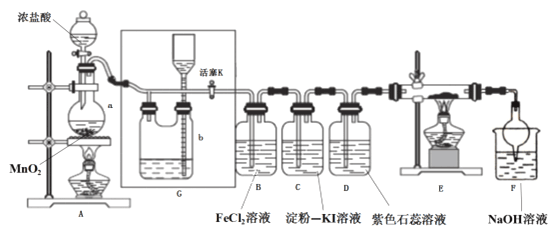
(1)A中发生反应的化学反应方程式为________
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
①在装置C、D中能看到的实验现象分别是 ________ 、________;
②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为_________;
③装置F中球形干燥管的作用是__________;
(3)储气瓶b内盛放的试剂是___________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com