
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为____________,该元素的符号是________。
(2)Y元素原子的价层电子的轨道表示式为___________,该元素的名称是________。
(3)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是________。
(4)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性并说明理由______________。
【答案】1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3 As ![]() 氧 As2O3+6Zn+6H2SO4(稀)=2AsH3↑+6ZnSO4+3H2O 稳定性:NH3>PH3>AsH3,因为非金属性越强,氢化物越稳定
氧 As2O3+6Zn+6H2SO4(稀)=2AsH3↑+6ZnSO4+3H2O 稳定性:NH3>PH3>AsH3,因为非金属性越强,氢化物越稳定
【解析】
X元素原子的4p轨道上有3个未成对电子,X元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,故X为As元素;Y元素原子的最外层2p轨道上有2个未成对电子,Y的2p轨道上有2个电子或4个电子,所以Y为碳元素或氧元素,X跟Y可形成化合物X2Y3,故Y为氧元素;X、Y和Z三种元素的原子序数之和等于42,则Z的质子数为42-8-33=1,则Z为氢元素,氢原子可以形成负一价离子,符合题意,据此结合原子结构与性质分析解答。
根据上述分析,X为As元素、Y为氧元素、Z为氢元素。
(1)由上述分析可知,X为As,X元素的基态原子核外电子排布式为1s22s22p63s23p63d104s24p3,故答案为:1s22s22p63s23p63d104s24p3;As;
(2)Y为O元素,名称为氧,原子基态时的电子排布式为1s22s22p4,其价电子的轨道表示式为![]() ,故答案为:
,故答案为:![]() ;氧;
;氧;
(3)X为As元素、Y为氧元素,Z为氢元素。化合物X2Y3为As2O3,XZ3为AsH3,As2O3在稀硫酸溶液中可被金属锌还原为AsH3,产物还有ZnSO4和H2O,反应中Zn元素化合价由0价升高为+2价,As元素化合价由+3价降低为-3价,参加反应的Zn与As2O3的物质的量之比为6×2∶2=6∶1,反应方程式为As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O,故答案为:As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O;
(4)X为As元素,非金属性越强,氢化物越稳定,非金属性N>P>As,所以稳定性NH3>PH3>AsH3,故答案为:稳定性:NH3>PH3>AsH3,因为非金属性越强,氢化物越稳定。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】试管是化学实验中最常用的玻璃仪器,对试管加热时,下列操作正确的是( )
A.试管外壁有水珠不一定要擦干,加热时会自然挥发
B.应握紧试管夹,大拇指按在短柄上
C.试管中液体的量不能超过试管容积的1/3
D.可以使试管的受热部位在火焰上方先上下移动,后集中加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由NaCl和BaCl2组成的混合溶液100 mL,分为两等份,向其中一份中加入50mL 0.60 mol·L-1的AgNO3溶液可使溶液中的Cl-沉淀完全;向另一份溶液中加入50 mL 0.20 mol·L-1的稀硫酸可使Ba2+刚好沉淀完全。则原溶液中c(Na+)(单位:mol·L-1)为( )
A. 0.1 B. 0.2 C. 0.4 D. 0.02
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成单质和化合物最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)C原子的价电子轨道表达式为______________________。
(2)碳元素是组成有机物必不可少的元素。1828年,化学家维勒首次用加热的方法将无机物氰酸铵[NH4(OCN)]转化为有机物尿素,开启了人造有机物的大门。氰酸铵中阳离子的立体构型是___________。有机物M( )在一定条件下生成N(
)在一定条件下生成N( )
)
①沸点:M___________N(填“大于”或“小于”)。
②M中碳原子的杂化类型为___________,不同杂化类型的碳原子数之比为___________。
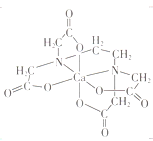
(3)碳的有机物常作为金属有机化合物的配体,如EDTA(乙二胺四乙酸)。EDTA与Ca2+形成的配离子如图所示。该配离子的配位数是___________,配体中碳原子的杂化方式有_________。
(4)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图所示,图中用实线标出了石墨的一个六方晶胞。

①石墨中C原子上未参与杂化的所有p轨道相互平行且重叠,使p轨道中的电子可在整个碳原子平面中运动而导电。六方氮化硼(BN)与石墨晶体结构类似,硼原子和氮原子交替相连,而六方BN却无法导电,其原因是___________。
②晶胞有两个基本要素:石墨一种晶胞结构和部分晶胞参数如图。

a.原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B的坐标参数分别为A(0,0,0)、B(0,1,![]() ),则C原子的坐标参数为___________。
),则C原子的坐标参数为___________。
b. 晶胞参数用以描述晶胞的大小和形状。已知石墨晶胞底边长为acm,层间距为 d cm,阿伏加德罗常数的值为NA,则石墨的密度为___________g·cm-3(写出表达式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素的原子序数依次递增。已知:①F的原子序数为29,其余的均为短周期主族元素;②E原子价电子(外围电子)排布为msnmpn-1;③D原子最外层电子数为偶数;④A、C原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)下列叙述正确的是________(填序号)。
A.金属键的强弱:D>E
B.基态原子第一电离能:D>E
C.五种元素中,电负性最大的元素是E
D.晶格能:NaCl<DCl2
(2)F基态原子的核外电子排布式为_____;与F同一周期的副族元素的基态原子中最外层电子数与F原子相同的元素为_____(填元素符号)。
(3)E单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
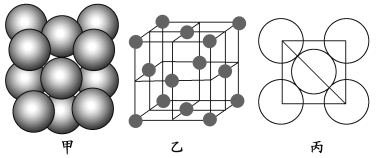
若已知E的原子半径为d,NA代表阿伏加德罗常数,E的相对原子质量为Mr,则一个晶胞中E原子的数目为________,该晶体的密度为_______________ (用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2010年4月,科学家成功合成了一种拥有117个质子的新元素。科学家用![]() Ca轰击
Ca轰击![]() Bk,生成了6个拥有117个质子的新原子,其中的5个原子有176个中子,1个原子有177个中子。下列有关说法正确的是( )
Bk,生成了6个拥有117个质子的新原子,其中的5个原子有176个中子,1个原子有177个中子。下列有关说法正确的是( )
A. 第117号元素是副族元素B. ![]() Bk的质量数为97
Bk的质量数为97
C. 第117号元素是非金属元素D. ![]() Ca2+的中子数比核外电子数多10
Ca2+的中子数比核外电子数多10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室测定青蒿素(只含C、H、O元素)中氧元素质量分数的实验装置如图所示,下列实验操作或叙述正确的是

A.D装置的目的仅是氧化青蒿素分解的氢气,使之完全转化为水
B.E、F中分别加入的是碱石灰和P2O5
C.确定氧元素的质量分数,需要的数据是实验前后装置C、E、F的质量变化
D.该实验的不足之处仅仅是F之后没有接盛有碱石灰的干燥管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。
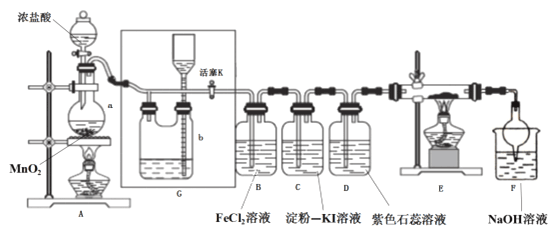
(1)A中发生反应的化学反应方程式为________
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
①在装置C、D中能看到的实验现象分别是 ________ 、________;
②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为_________;
③装置F中球形干燥管的作用是__________;
(3)储气瓶b内盛放的试剂是___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某2.0L硫酸溶液中含有1.0molH2SO4。试计算:
(1)溶液中H2SO4的物质的量浓度。___________
(2)向上述溶液中加入足量的铁粉,产生气体的体积(标准状况下)。____________
(3)假设反应前后溶液体积不变,则所得溶液中FeSO4的物质的量浓度。____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com