
【题目】某2.0L硫酸溶液中含有1.0molH2SO4。试计算:
(1)溶液中H2SO4的物质的量浓度。___________
(2)向上述溶液中加入足量的铁粉,产生气体的体积(标准状况下)。____________
(3)假设反应前后溶液体积不变,则所得溶液中FeSO4的物质的量浓度。____________
【答案】0.5mol/L 22.4L 0.5mol/L
【解析】
(1)根据c=![]() 计算溶液的浓度;
计算溶液的浓度;
(2)根据反应的方程式列式计算,反应为:Fe+H2SO4=FeSO4+H2↑;
(3)反应后溶液成分为FeSO4,根据H2SO4的物质的量计算。
(1)c(H2SO4)=1.0mol÷2L=0.5mol/L,
答:溶液中H2SO4的物质的量浓度为0.5mol/L;
(2)根据反应的方程式列式计算:
Fe+H2SO4=FeSO4+H2↑
1mol 22.4 L
1.0 mol V(H2)
V(H2)=1.0mol×22.4L÷1mol=22.4L,
答:产生气体的体积为22.4L;
(3)n(FeSO4)=n(H2SO4)=1.0 mol
c(FeSO4)=1.0mol÷2LL=0.5 mol/L
答:所得溶液中FeSO4的物质的量浓度为0.5 mol/L。


科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为____________,该元素的符号是________。
(2)Y元素原子的价层电子的轨道表示式为___________,该元素的名称是________。
(3)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是________。
(4)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性并说明理由______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入足量NaOH溶液,充分反应后消耗 a mol NaOH ,另取一份加入足量盐酸,充分反应后消耗b mol HCl,则该混合溶液中c(Na+)为 ( ) (已知:NaHCO3 + NaOH = Na2CO3 + H2O)
A.(![]() )mol/LB.(
)mol/LB.(![]() )mol/L
)mol/L
C.(10b-5a) mol/LD.(2b-a) mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别燃烧等物质的量的下列各组物质,其中消耗氧气的量相等的是( )
①C2H2与C2H4O ②C4H8与C6H12O6 ③C7H8与C6H12 ④HCOOCH3与CH3COOH.
A.①③④ B.①②③④ C.①④ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两种物质:

(1)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
![]()
其中反应I的反应类型是___________,反应II的条件是_______________,反应III的化学方程式为___________________________________(不需注明反应条件)。
(2)下列物质不能与乙反应的是 (选填序号)。
a.金属钠 b.溴水 c.碳酸钠溶液 d.乙酸
(3)乙有多种同分异构体,任写其中一种能同时满足下列条件的同分异构体结构简式 。
a.苯环上的一氯代物有两种
b.遇FeCl3溶液显示紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
I.下列各组中的两种有机物,可能是:(A)相同的物质,(B)同系物,(C)同分异构体。请判断它们之间的关系(用A、B、C填空)
① 2-甲基丁烷和丁烷________________, ②正戊烷和2,2-二甲基丙烷____________,③对二甲苯和1,4—二甲苯____________ , ④ 1-已烯和环已烷________________。
II.按官能团的不同,可以对有机物进行分类,将符合要求的答案填在横线上。
① CH3CH2CH2COOH ② ![]() ③
③![]()
④ ![]() ⑤
⑤ ![]() ⑥
⑥ 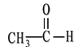
(1)芳香烃:__________;
(2)卤代烃:____________;
(3)酚:_______________;
(4)醛:______________;
(5)羧酸:______________;
(6)酯:_______________。
III.(1)画出羟基和乙烯的电子式:羟基 __________,乙烯 __________。
(2)用系统命名法给下列有机物命名
![]() ___________________________;
___________________________;
②![]() ___________________________________;
___________________________________;
(3)相对分子质量为114,其一氯代物只有一种的链烃的结构简式 ___________该物质的名称为________________;
(4)某烃1分子含有50个电子,该烃只能由一种结构的炔烃加氢得到,则该烃的键线式为 _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用63%的浓HNO3 (其密度为1.40 g·mL-1)配制200 mL 0.50 mol·L-1稀HNO3。
(1)此浓硝酸的物质的量浓度为________mol·L-1。(计算结果保留两位小数)
(2)应量取63%的浓硝酸____________mL,应选用________( A.10 mL量筒或B.50 mL量筒,填仪器的字母编号)。
(3)实验时还需选用的玻璃仪器有玻璃棒、烧杯、_______________(填仪器的名称)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)________。
①量取浓硝酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③定容时俯视
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如图。
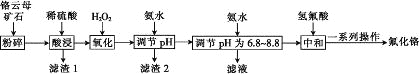
表中列出了相关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 | Fe(OH)2 |
开始沉淀的pH | 2.3 | 8.8 | 4.9 | 7.5 |
沉淀完全的pH | 4.1 | 10.4 | 6.8 | 9.7 |
请回答下列问题:
(1)Fe2O3、MgO、FeO、SiO2中属于碱性氧化物的有________种。
(2)将铬云母矿石粉碎的目的是________。
(3)滤渣1主要成分的用途是________。(写一种)
(4)Cr2O3与稀硫酸反应的化学方程式为___________。
(5)第一次滴加氨水调节pH范围为________。
(6)第二次滴加氨水调节pH为6.8~8.8的目的是_______,Cr(OH)3与 Al(OH)3一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.
工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:
①CO( g)+2H2(g)![]() CH3OH( g)△H1=-91kJ·mol-1
CH3OH( g)△H1=-91kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H2=-24kJ·mol-1
CH3OCH3(g)+H2O(g)△H2=-24kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g)△H3=-41kJ·mol-1
CO2(g)+H2(g)△H3=-41kJ·mol-1
回答下列问题:
(1)新工艺的总反应为:3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g),该反应△H=______,一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
CH3OCH3(g)+CO2(g),该反应△H=______,一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度d.增加CO的浓度 e.分离出二甲醚
(2)已知反应④2CH3OH(g)![]()
![]() CH3OCH3(g)+H2O(g),某温度下,在1L密闭容器中加入CH3OH,反应10min时达到平衡,此时各组分的浓度如下:
CH3OCH3(g)+H2O(g),某温度下,在1L密闭容器中加入CH3OH,反应10min时达到平衡,此时各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.01 | 0.2 | 0.2 |
①平衡常数表达式K=______,该温度的平衡常数为______。
②若加入CH3OH后,经10 min后达到平衡,该时间内的平均反应速率v(CH3OH)=________。
工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com