
【题目】把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入足量NaOH溶液,充分反应后消耗 a mol NaOH ,另取一份加入足量盐酸,充分反应后消耗b mol HCl,则该混合溶液中c(Na+)为 ( ) (已知:NaHCO3 + NaOH = Na2CO3 + H2O)
A.(![]() )mol/LB.(
)mol/LB.(![]() )mol/L
)mol/L
C.(10b-5a) mol/LD.(2b-a) mol/L
【答案】C
【解析】
设100mL溶液中含有NH4HCO3xmol,Na2CO3ymol,NH4HCO3和Na2CO3的混合溶液加入NaOH,反应为:
NH4HCO3+2NaOH═NH3·H2O+Na2CO3+H2O,
1 2
x amol
解得:x=0.5amol;故:NH4HCO3为0.5amol;
加入含b mol HCl的盐酸的反应为:
NH4HCO3+HCl═NH4Cl+CO2↑+H2O,Na2CO3+2HCl═2NaCl+H2O+CO2↑,
1 1 1 2
0.5amol n(HCl) y b-n(HCl)
解得:n(HCl)=0.5amol,y=![]() (b-0.5amol);
(b-0.5amol);
n(Na+)=2n(Na2CO3)=(b-0.5a)mol,
c(Na+)=![]() =(10b-5a)mol/L。
=(10b-5a)mol/L。
答案选C。


科目:高中化学 来源: 题型:
【题目】由NaCl和BaCl2组成的混合溶液100 mL,分为两等份,向其中一份中加入50mL 0.60 mol·L-1的AgNO3溶液可使溶液中的Cl-沉淀完全;向另一份溶液中加入50 mL 0.20 mol·L-1的稀硫酸可使Ba2+刚好沉淀完全。则原溶液中c(Na+)(单位:mol·L-1)为( )
A. 0.1 B. 0.2 C. 0.4 D. 0.02
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室测定青蒿素(只含C、H、O元素)中氧元素质量分数的实验装置如图所示,下列实验操作或叙述正确的是

A.D装置的目的仅是氧化青蒿素分解的氢气,使之完全转化为水
B.E、F中分别加入的是碱石灰和P2O5
C.确定氧元素的质量分数,需要的数据是实验前后装置C、E、F的质量变化
D.该实验的不足之处仅仅是F之后没有接盛有碱石灰的干燥管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。
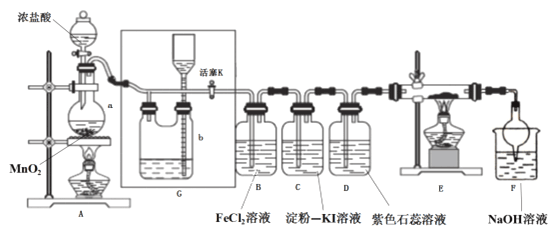
(1)A中发生反应的化学反应方程式为________
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
①在装置C、D中能看到的实验现象分别是 ________ 、________;
②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为_________;
③装置F中球形干燥管的作用是__________;
(3)储气瓶b内盛放的试剂是___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发射“神舟七号”载人飞船的是我国自行研制的“长征一号D”运载火箭。该火箭的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:R+2N2O4=3N2+4H2O+2CO2,下列叙述错误的是( )
A.此反应是氧化还原反应B.该反应产物均为非电解质
C.R的分子式为![]() D.反应瞬间产生大量高温气体,推动火箭飞行
D.反应瞬间产生大量高温气体,推动火箭飞行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列反应曾用于检测司机是否酒后驾驶:2![]() +3CH3CH2OH+16H++13H2O
+3CH3CH2OH+16H++13H2O![]() 4[Cr(H2O)6]3++3CH3COOH
4[Cr(H2O)6]3++3CH3COOH
①配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是___(填元素符号)。
②CH3COOH中C原子轨道杂化类型为___;1 mol CH3COOH分子含有σ键的数目为___。
(2)CS2分子中,C原子的杂化轨道类型是____,写出两个与CS2具有相同空间构型和键合形式的离子____。
(3)石墨烯是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯。
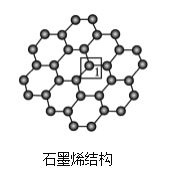
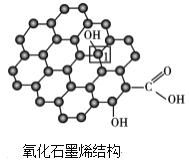
氧化石墨烯中,1号C的杂化方式是____,该C与相邻C形成的C-C键角____(填“>”、“<”或“=”)石墨烯中与1号C相邻C形成的C-C键角。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钠-过氧化氢加合物的化学式可表示为xNa2SO4·yH2O2·zH2O, (其中x、y、z为各成分物质的量的最简整数比),其化学式可通过下列实验测定:
①准确称取 8.850g 样品,配制成 250mL 溶液A;
②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液,反应至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体1.165g ;
③准确量取25.00mL溶液A,加入适量稀硫酸酸化后,用0.02000 mol·L-1 KMnO4溶液与H2O2反应,消耗0.0010 mol KMnO4。 H2O2与KMnO4反应的方程式如下:
2KMnO4+5H2O2+3H2SO4 =2MnSO4+5O2↑+ K2SO4+8H2O
计算 8.850 g 样品中:
(1)Na2SO4的物质的量为___________________
(2)H2O2的物质的量为________________
(3)该硫酸钠-过氧化氢加合物的化学式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某2.0L硫酸溶液中含有1.0molH2SO4。试计算:
(1)溶液中H2SO4的物质的量浓度。___________
(2)向上述溶液中加入足量的铁粉,产生气体的体积(标准状况下)。____________
(3)假设反应前后溶液体积不变,则所得溶液中FeSO4的物质的量浓度。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是
A. 某溶液![]() 有白色沉淀,说明原溶液中有Cl-
有白色沉淀,说明原溶液中有Cl-
B. 某溶液![]() 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-
C. 某溶液![]() 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+
D. 某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com