
【题目】[化学——选修5:有机化学基础]环丙贝特(H)是一种降血脂药物,可明显降低极低密度和低密度脂蛋白水平,并升高高密度脂蛋白,通过改善胆固醇的分布,可减少CH和LDL在血管壁的沉积,还有溶解纤维蛋白和阻止血小板凝聚作用。如图是合成环丙贝特的一种新方法:
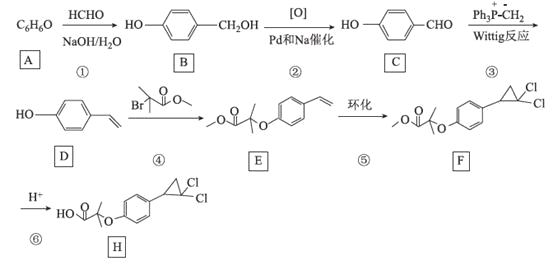
回答下列问题:
(1)C的化学名称为______________________
(2)F中含氧官能团的名称为______________
(3)H的分子式为________________________
(4)反应①的反应类型为___________,反应④的化学方程式为______________________
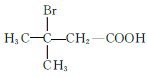
(5)M为![]() 的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
(6)利用Wittig反应,设计以环己烷为原料(其他试剂任选),制备![]() 的合成路线:______________________。
的合成路线:______________________。
【答案】对羟基苯甲醛(或4-羟基苯甲醛) 酯基、醚键 C13H14O3Cl2 加成反应 ![]() +
+![]() →
→![]() +HBr 12
+HBr 12 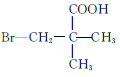 、
、
【解析】
A(![]() )与HCHO在碱性条件下发生加成反应生成B(
)与HCHO在碱性条件下发生加成反应生成B(![]() );B氧化生成C(
);B氧化生成C(![]() );C生成D(
);C生成D(![]() );D与
);D与![]() 发生取代反应生成E(
发生取代反应生成E(![]() )和HBr;E环化生成F(
)和HBr;E环化生成F(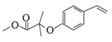 );F酸性条件下水解生成H(
);F酸性条件下水解生成H(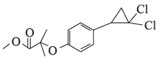 ),据此分析。
),据此分析。
(1)C为![]() ,命名为对羟基苯甲醛(或4-羟基苯甲醛);
,命名为对羟基苯甲醛(或4-羟基苯甲醛);
答案:对羟基苯甲醛(或4-羟基苯甲醛)
(2)F为 ,F中含氧官能团为酯基、醚键;
,F中含氧官能团为酯基、醚键;
答案:酯基、醚键
(3)H为 ,由结构简式可知,H的分子式为C13H14O3Cl2;
,由结构简式可知,H的分子式为C13H14O3Cl2;
答案:C13H14O3Cl2
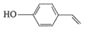
(4)反应①为加成反应,反应④为取代反应,产物中还有HBr,化学方程式为![]() +
+![]() →
→![]() +HBr;
+HBr;
答案:加成反应 ![]() +
+![]() →
→ span>+HBr
span>+HBr
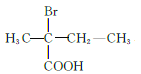
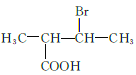
(5)M为![]() 的同分异构体,满足条件的M的结构简式为
的同分异构体,满足条件的M的结构简式为 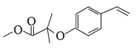 、
、 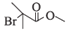 、
、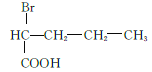 、
、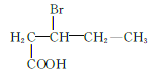 、
、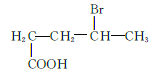 、
、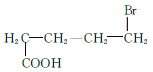 、
、 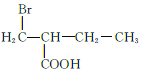 、
、 、
、  、
、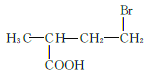 、
、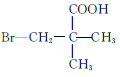 、
、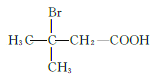 共12种;其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为
共12种;其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为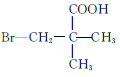 、
、 ;
;
答案:12种 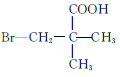 、
、
(6)根据题干信息①②③可得出合成路线,由环己烷为原料制备![]() 的合成路线为
的合成路线为 ;
;
答案:


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g) +D(g)发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是
C(g) +D(g)发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是
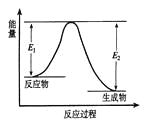
A. 反应体系中加入催化剂,反应速率增大,E1减小,E2增大
B. 反应体系中加入催化剂,反应速率增大,△H不变
C. △H < 0,反应达到平衡时,升高温度,A的转化率增大
D. △H > 0,反应达到平衡时,升高温度,A的转化率减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用以下装置制备并检验Cl2的性质。下列说法正确的是( )
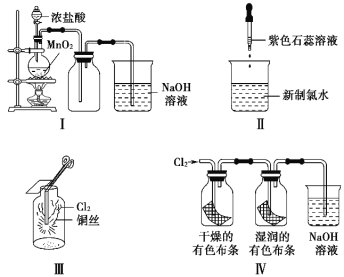
A. Ⅰ图:若MnO2过量,则浓盐酸可全部消耗完
B. Ⅱ图:证明新制氯水只有酸性
C. Ⅲ图:产生了棕黄色的雾
D. Ⅳ图:湿润的有色布条褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法正确的是
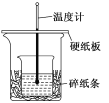
A. 如图条件下实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎纸条的作用是固定小烧杯
D. 若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,从理论上说所求中和热不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是![]() 和
和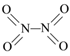 。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式_________________________
(2)对反应N2O4(g)![]() 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是______
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是______
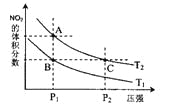
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为_____mol·(L·s)-1。
②n3____n4(填“>”、“<”或“=”),该反应的平衡常数K的值为_____________,升高温度后,反应2NO2![]() N2O4的平衡常数K将_______(填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将_______(填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2
④计算③中条件下达到平衡后混合气体的平均相对分子质量为____________。(结果保留小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铝热反应焊接钢轨的原理是2Al+Fe2O3![]() 2Fe+Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褐色硬块的组成。
2Fe+Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褐色硬块的组成。
(1)将褐色硬块处理成粉末状。研究小组首先排除了含有单质Al杂质的可能性,实验方法是________,证明不含单质铝的现象是_____________。
(2)该褐色硬块的组成基本确定为Fe、Fe2O3,Al2O3。请以上述粉末为样品,验证其组成。限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20% KSCN、3 mol·L-1NaOH、3 mol·L-1HCl、3 mol·L-1HNO3、3 mol·L-1CuSO4、0.01 mol·L-1KMnO4、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。_____________。
实验操作 | 预期现象和结论 |
步骤1: | |
步骤2: | |
步骤3: | |
步骤4: |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘酸钾常用作食盐加碘剂以防止缺碘疾病,也是常用的基准物质和氧化剂。工业上碘酸钾可用如图所示装置进行制备。下列说法错误的是( )
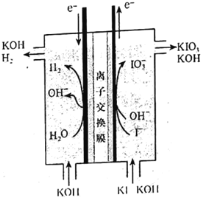
A.其阳极反应式是I-+3H2O-6e-=IO![]() +6H+
+6H+
B.该工业过程中KOH是循环利用的物质
C.制得21.4gKIO3产生标况下H26.72L
D.该工业过程使用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中的一部分,列出10种元素在元素周期表中的位置.用化学符号回答下列各问题.
周期 |
|
|
|
|
|
|
| 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)10种元素中,化学性质最不活泼的是_________.
(2)①、③、⑤三种元素最高价氧化物对应水化物中,碱性最强的是_________.
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是_________.
(4)元素⑦的简单氢化物的化学式为_____;若该氢化物和元素⑨的单质反应,则化学方程式为_______.
(5)⑤和⑨的最高价氧化物对应水化物的化学式分别为_________和_________.
(6)①和⑤最高价氧化物对应水化物相互反应的离子方程式为__________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com