
【题目】某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法正确的是
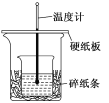
A. 如图条件下实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎纸条的作用是固定小烧杯
D. 若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,从理论上说所求中和热不相等
【答案】B
【解析】
A.根据实验过程的保温情况确定保温效果;
B.根据量热计的构造来判断该装置的缺少仪器;
C.根据烧杯间填满碎纸条的作用是保温;
D.中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关。
A.该装置的保温效果并不如量热计那样好,大小烧杯之间要填满纸片,装置存在热量的散失,故A错误;
B.根据量热计的构造可以知道该装置的缺少仪器是环形玻璃搅拌棒,所以B选项是正确的;
C.中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,故C错误;
D.中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关,中和热数值相等,故D错误;
所以B选项是正确的。


科目:高中化学 来源: 题型:
【题目】在一定温度下,容积一定的密闭容器中发生反应A(s)+2B(g)![]() C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是
C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是
①混合气体的密度 ②混合气体的压强 ③B的物质的量浓度 ④混合气体的总物质的量
A. ①② B. ②③ C. ①③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热测定实验中,下列操作会使测得的H偏小的是( )
A.大烧杯上没有盖硬纸板
B.用环形铜丝搅拌棒代替环形玻璃搅拌棒
C.用相同浓度和体积的硝酸代替稀盐酸溶液进行实验
D.用1gNaOH固体代替50mL0.5mol/L的NaOH溶液进行实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸乙烯(CH3COOCH=CH2)是一种重要的有机化工原料,以二甲醚(CH3OCH3)与合成气(CO、H2)为原料,醋酸锂、碘甲烷等为催化剂,在高压反应釜中一步合成醋酸乙烯及醋酸。
回答下列问题:
(1)常温下,将浓度均为a mol/L的醋酸锂溶液和醋酸溶液等体积混合,测得混合液的pH=b,则混合液中c(CH3COO-)=______mol/L( 列出计算式即可)。
(2)合成二甲醚:
Ⅰ.2H2(g)+CO(g)=CH3OH(g) ΔH1=-91.8kJ/mol;
Ⅱ.2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ/mol;
Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.3 kJ/mol.
已知:H-H 的键能为436kJ/mol,C=O的键能为803kJ/mol,H-O的键能为464kJ/mol,则C≡O的键能为_____kJ/mol.
(3)二甲醚(DME)与合成气一步法合成醋酸乙烯(VAC)的反应方程式为2CH3OCH3(g)+4CO(g)+H2(g) ![]() CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
①0~10min内,用CO浓度变化表示的平均反应速率v(CO)=______;该温度下,该反应的平衡常数K=__________。
②下列能说明该反应达到平衡状态的是______(填选项字母)。
A.V正(DME)=v逆(H2)≠0
B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化
D.c(CO):c(VAC)=4:1
③如图是反应温度对二甲醚(DME)的转化率和醋酸乙烯(VAC)选择性(醋酸乙烯的选择性Svac=![]() )的影响,该反应的ΔH______0(填“>”“<”或“=”);控制的最佳温度是___________.
)的影响,该反应的ΔH______0(填“>”“<”或“=”);控制的最佳温度是___________.

④保持温度不变,向反应釜中通入氩气增大压强,则化学平衡______(填“向正反应方向”“向逆反应方向"或“不”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是

A. 图甲中(1)、(2)两个实验中H2O2分解的△H相同
B. 图乙实验可通过测定相同状况下,产生的气体体积与反应时间来比较反应速率
C. 图甲实验可通过观察产生气泡的快慢来比较反应速率
D. 图乙中,测定反应速率的装置可将分液漏斗用长颈漏斗替代 ,其测定结果相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.固态Na2O2和熔融态NaHSO4中的阴、阳离子个数比不同
B.每个水分子内含有两个氢键
C.碘晶体受热转变成碘蒸气,破坏了共价键
D.干冰溶于水生成碳酸的过程只需克服分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3A(g)+B(g)![]() 2C(g)+2D(s)在2 L密闭容器中进行,经过4min,B减少了0.4 mol,则0~4min内此反应的平均速率为
2C(g)+2D(s)在2 L密闭容器中进行,经过4min,B减少了0.4 mol,则0~4min内此反应的平均速率为
A. v(A)=0.15 mol·L1B. v(B)=0.05 mol·L1·s1
C. v(C)=0.10 mol·L1·min1D. v(D)=0.10 mol·L1·min1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质分类和实验探究都是中学化学重要的学科思想。
(一)以下是对“一些物质与水反应”的分类图,请按要求填空:

上述分类方法是______;A组物质中属于电解质的是_____(填化学式);C组物质与水反应的离子方程式为_____;D组物质与水反应中,氧化剂和还原剂物质的量之比为1∶2的物质是___(填化学式)。
(二)用质量分数为98%的浓硫酸(密度为1.84 g·cm3)配制240 mL浓度为0.5 mol·L-1的硫酸溶液,选用到的仪器正确的是______(填序号)。

下列操作会使配制结果偏高的是_______(填序号)
A 容量瓶用蒸馏水洗净后,未进行干燥处理
B 稀释的硫酸转移到容量瓶中后未洗涤烧杯
C 未冷却,即将溶液注入容量瓶并定容
D定容时,俯视容量瓶的刻度线
(三)某小组用如下装置比较氯、溴、碘的非金属性强弱实验(夹持仪器已略去,气密性已检验)。

实验步骤:
①打开弹簧夹,打开活塞a,滴加浓盐酸;
②当B和C中的溶液都变为黄色时,夹紧弹簧夹;
③当B中溶液由黄色变为棕红色时,关闭活塞a;
④打开活塞b,将少量C中溶液滴入试管D中,关闭活塞b,取下试管D振荡,静置后CCl4层变为紫红色。
请回答:
(1)装置A中证明氯的非金属性强于碘的实验现象是_________。
(2)B中溶液发生反应的离子方程式是_______________。
(3)步骤③实验的目的是确认C的黄色溶液中无_____(填化学式)。步骤④能否说明非金属性:Br>I_______(填“能”或“否”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.离子键就是阴、阳离子间的静电引力和静电斥力
B.所有金属元素与所有非金属元素间都能形成离子键
C.钠原子与氯原子结合形成离子键
D.在离子化合物 CaCl2 中,两个氯离子间也存在离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com