
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是

A. 图甲中(1)、(2)两个实验中H2O2分解的△H相同
B. 图乙实验可通过测定相同状况下,产生的气体体积与反应时间来比较反应速率
C. 图甲实验可通过观察产生气泡的快慢来比较反应速率
D. 图乙中,测定反应速率的装置可将分液漏斗用长颈漏斗替代 ,其测定结果相同
【答案】D
【解析】
A. 催化剂只降低反应的活化能,改变反应路径,不改变反应的反应热;
B.为比较Fe3+和Cu2+对H2O2分解的催化效果,可以在相同条件下,通过收集相同气体体积所需的时间或相同时间收集气体的体积来比较反应速率;
C. 据反应剧烈程度和反应现象的关系判断;
D. 产生的气体从长颈漏斗逸出,不能测定气体的体积。
A. 催化剂只降低反应的活化能,改变反应路径,不改变反应的反应热,所以(1)、(2)两个实验中H2O2分解的△H相同,所以A选项是正确的;
B. 为比较Fe3+和Cu2+对H2O2分解的催化效果,可以在相同条件下,通过收集相同气体体积所需的时间或相同时间收集气体的体积来比较反应速率,所以B选项是正确的;
C. 反应速率可以通过观察产生气泡的快慢来判断,所以C选项是正确的;
D. 产生的气体从长颈漏斗逸出,不能测定气体的体积,应利用分液漏斗或长颈漏斗下端进入液面下,所以D选项是错误的。
故答案选D。


 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:
【题目】甲容器中进行如下反应4A(s)+3B(g)![]() 2C(g)+D(g),经2 min,B的浓度减少0.6 mol/L。对此反应速率的下列说法正确的是
2C(g)+D(g),经2 min,B的浓度减少0.6 mol/L。对此反应速率的下列说法正确的是
A. 在2 min末的反应速率,用B表示是 0.3 mol/(L·min)
B. 用A表示的反应速率是0.4 mol/(L·min)
C. 若乙容器中也同时进行此反应,且相同时间段内用D表示的速率是0.2 mol/(Lmin),则乙容器中反应速率更快
D. 对甲容器升高温度,则正反应速率将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电动自行车由于灵活、快捷、方便,已成为上班族的主要代步工具,其电源常采用铅蓄电池。反应原理:Pb(s)+PbO2(s)+2H2SO4(aq) ![]() 2PbSO4(s)+2H2O(l)。根据此反应判断下列叙述错误的是( )
2PbSO4(s)+2H2O(l)。根据此反应判断下列叙述错误的是( )
A. 放电时负极反应:Pb(s)+SO42-(aq)-2e- = PbSO4(s)B. 放电时化学能转化为电能
C. 放电时,电解液的密度增大D. 放电时,正负极质量都增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法生产锰时会产生大量的阳极泥,其主要成分为MnO2和Pb,还含有少量其他金属化合物。下图是回收电解锰阳极泥生产MnCO3的工艺流程。

已知:Al(OH)3、Mn(OH)2、MnCO3的Ksp分别为1.0×10-33、1.9×10-13、2.2×10-11。
(l)“还原酸浸”时氧化产物为CO2,发生反应的化学方程式为____。
(2)“还原酸浸”实验中,锰的浸出率结果如图所示。由图可知,所采用的最佳实验条件为 ____ 。

(3)滤液l中的阳离子组成见下表:
组成 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
浓度/(mol·L-1) | 0.85 | 2.4×10-3 | 1.0×10-2 | 2.0×10-3 |
“除杂”时先加MnO2,MnO2的作用为 ___。
再加氨水调节pH使杂质离子沉淀完全,通过计算说明Al3+沉淀完全时Mn2+是否开始沉淀 ___。
(4)“沉锰”时发生反应的离子方程式为 ___。
(5)“沉锰”的关键操作有2点:①将NH4HCO3溶液滴入MnSO4溶液中;②反应终点pH=7。如果颠倒试剂滴加顺序,将MnSO4溶液滴人NH4HCO3,溶液中,或反应终点pH>7可能造成同样的后果,该后果是____;如粜反应终点pH<7,可能的后果是______。
(6)从滤液2中回收得到的副产品的用途为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= —24.8 kJ·mol-1;3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47.2kJ·mol-1 ;Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +19.4kJ·mol-1则14g CO气体与足量FeO充分反应得到Fe单质和CO2气体时的释放或吸收的热量为
A. 放出11 kJ B. 放出5.5kJ C. 吸收11 kJ D. 吸收5.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法正确的是
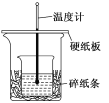
A. 如图条件下实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎纸条的作用是固定小烧杯
D. 若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,从理论上说所求中和热不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) ΔH1=-26.7 kJ·mol-1
②3Fe2O3(s)+CO(g)= 2Fe3O4(s)+CO2(g) ΔH2=-50.75 kJ·mol-1
③Fe3O4(s)+CO(g)= 3FeO(s)+CO2(g) ΔH3=-36.5 kJ·mol-1
则试通过计算判断,下列有关反应FeO(s)+CO(g)=Fe(s)+CO2(g)的能量变化示意图正确的是

A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com