
【题目】已知下列热化学方程式:
①Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) ΔH1=-26.7 kJ·mol-1
②3Fe2O3(s)+CO(g)= 2Fe3O4(s)+CO2(g) ΔH2=-50.75 kJ·mol-1
③Fe3O4(s)+CO(g)= 3FeO(s)+CO2(g) ΔH3=-36.5 kJ·mol-1
则试通过计算判断,下列有关反应FeO(s)+CO(g)=Fe(s)+CO2(g)的能量变化示意图正确的是

A. A B. B C. C D. D
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
实验序号 | 实验温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
V(mL) | C(mol/L) | V(mL) | C(mol/L) | V(mL) | t(s) | ||
A | 293K | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313K | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出_______的改变对反应速率的影响,其中V1=_____,T1=_____,通过实验_______可探究出温度变化对化学反应速率的影响。
(2)若t1<8,则由实验A、B可以得出的结论是________________________span>;利用实验B中数据计算,从反应开始到有结束,用KMnO4的浓度变化表示的反应速率为____________。
(3)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式_______。
(4)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是_______________,相应的粒子最有可能是(填符号)_______。
II.100kPa时,反应2NO(g)+O2(g)![]() 2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)
2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)![]() N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
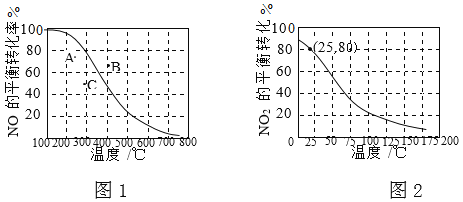
① 图1中A、B、C三点表示不同温度、压强下2NO(g)+O2(g)![]() 2NO2(g)达到平衡时NO的转化率,则________点对应的压强最大。
2NO2(g)达到平衡时NO的转化率,则________点对应的压强最大。
② 100kPa、25℃时,2NO2(g)![]() N2O4(g)平衡体系中,列式计算平衡常数Kp=________。(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
N2O4(g)平衡体系中,列式计算平衡常数Kp=________。(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有SO42-、SO32-、HCO3-、CO32-等四种离子。将过量的Na2O2固体加入其中后,仍能大量存在的离子是( )
A.SO42-、HCO3-B.SO42-、SO32-、CO32-
C.SO32-、HCO3-D.SO42-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.现有一瓶无色澄清溶液,可能由Na+、K+、NH4+、Fe2+、SO42-、I-、CO32-、Cl-、SO32-、MnO4-中的几种组成,请根据以下实验步骤及现象回答下列问题:
步骤一:取适量待测液,加入NaOH溶液并加热,得到溶液A,并产生刺激性气味的气体;
步骤二:向溶液A中加入足量稀盐酸和BaCl2溶液,得到溶液B、白色沉淀及有刺激性气味的气体;
步骤三:向溶液B中通入适量Cl2,得到黄褐色溶液C。
(1)下列有关该溶液说法正确的是________________(填字母)。
A 一定存在SO42-、I-、NH4+、SO32- B 一定不存在Fe2+、CO32-、MnO4-
C 可能存在CO32-、Cl-、Na+、K+、 D 可用AgNO3溶液确认原溶液中是否存在Cl-
(2)步骤三得到黄褐色溶液的离子方程式是____________________。
(3)若向原溶液中先加入足量的盐酸,再加入足量的______________(填化学式)并加热,也能得出步骤一、步骤二相同的结论。
(4)对于溶液中还可能存在的阳离子,确认其存在的实验方法是__________________。
II.用一定质量的铜片和25.0 mL 18.0 mol·L-1的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为d mol·L-1,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾____________mol(用含d的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实所引出的相应结论正确的是
选项 | 实验事实 | 结论 |
A | 其他条件相同,Na2S2O3 溶液浓度越大, 析出硫沉淀所需时间越短 | 当其他条件不变时,增大反应物浓度化学反应速率加快 |
B | 在化学反应前后,催化剂的质量和化学性质都没有发生改变 | 催化剂一定不参加化学反应 |
C | H+浓度相同的盐酸和醋酸分别与等质量的形状相同的锌粒反应 | 反应开始时速率相同 |
D | 在容积可变的密闭容器中发生反应H2(g)+I2(g) | 正反应速率加快,逆反应速率不变 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究海水提溴工艺,甲、乙两同学分别设计了如下实验流程:
甲:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
乙:![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)蒸馏过程中温度应控制在80℃~90℃,温度过高或过低都不利于生产,原因是_______。
(2)甲同学步骤④所发生反应的离子方程式为_______。
(3)某同学在进行蒸馏操作时,采用如图所示装置:
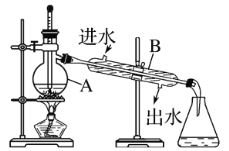
①仪器A的名称是_____
②写出图中两处明显的错误:________。
③实验时A中除加入混合溶液外,还需加入少量_____,其作用是___。
(4)对比甲、乙两流程,最大的区别在于对含溴海水的处理方法不同,其中符合工业生产要求的是____(填“甲”或“乙”),理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
A.  收集 NOB.
收集 NOB.  制备 NH3
制备 NH3
C.  制备 Fe(OH)2D.
制备 Fe(OH)2D.  稀释浓 H2SO4
稀释浓 H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A(g) ![]() B(g) + D(g)在四种不同的条件下进行,B、D起始浓度为0,反应物A的浓度随反应时间的变化情况如下表:
B(g) + D(g)在四种不同的条件下进行,B、D起始浓度为0,反应物A的浓度随反应时间的变化情况如下表:
实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
(1) | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
(2) | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
(3) | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
(4) | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,下列说法错误的是
A. 在(1)中,反应在10~20 min内A的平均速率为0.013 mol/(L·min)
B. 在(2)中,A的初始浓度c2<1.0 mol/L
C. 设(3)的反应速率为υ3,(1)的反应速率为υ1,则υ3 > υ1
D. 比较(1)和(4),可推测该反应的正反应是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com