
����Ŀ����ij�о���ѧϰ������H2C2O4��Һ������KMnO4��Һ֮��ķ�Ӧ��̽������������ı�Ի�ѧ��Ӧ���ʵ�Ӱ�족��ʵ�����£�
ʵ����� | ʵ���¶� | KMnO4��Һ | H2C2O4��Һ | H2O | ��Һ��ɫʱ�� | ||
V(mL) | C(mol/L) | V(mL) | C(mol/L) | V(mL) | t(s) | ||
A | 293K | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313K | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
��1��ͨ��ʵ��A��B����̽����_______�ĸı�Է�Ӧ���ʵ�Ӱ�죬����V1=_____��T1=_____��ͨ��ʵ��_______��̽�����¶ȱ仯�Ի�ѧ��Ӧ���ʵ�Ӱ�졣
��2����t1��8������ʵ��A��B���Եó��Ľ�����________________________span>������ʵ��B�����ݼ��㣬�ӷ�Ӧ��ʼ���н�������KMnO4��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ____________��
��3���÷�Ӧ������ɫ��ζ������������̱���ԭΪMn2+��д����Ӧ��Ӧ�����ӷ���ʽ_______��
��4����С���һλͬѧͨ���������Ϸ��֣���Ӧһ��ʱ���÷�Ӧ���ʻ�ӿ죬��ɴ��ֱ仯��ԭ���Ƿ�Ӧ��ϵ�е�ij�����Ӷ�KMnO4��H2C2O4֮��ķ�Ӧ��ij����������ã����������_______________����Ӧ���������п����ǣ�����ţ�_______��
II.100kPaʱ����Ӧ2NO(g)+O2(g)![]() 2NO2(g)��NO��ƽ��ת�������¶ȵĹ�ϵ������ͼ1����Ӧ2NO2(g)
2NO2(g)��NO��ƽ��ת�������¶ȵĹ�ϵ������ͼ1����Ӧ2NO2(g)![]() N2O4(g)��NO2��ƽ��ת�������¶ȵĹ�ϵ������ͼ2��
N2O4(g)��NO2��ƽ��ת�������¶ȵĹ�ϵ������ͼ2��
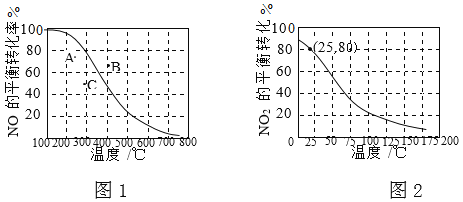
�� ͼ1��A��B��C�����ʾ��ͬ�¶ȡ�ѹǿ��2NO(g)+O2(g)![]() 2NO2(g)�ﵽƽ��ʱNO��ת���ʣ���________���Ӧ��ѹǿ���
2NO2(g)�ﵽƽ��ʱNO��ת���ʣ���________���Ӧ��ѹǿ���
�� 100kPa��25��ʱ��2NO2(g)![]() N2O4(g)ƽ����ϵ�У���ʽ����ƽ�ⳣ��Kp��________����Kp��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ���������
N2O4(g)ƽ����ϵ�У���ʽ����ƽ�ⳣ��Kp��________����Kp��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ���������
���𰸡�Ũ�� 1 293K BC ����������ͬʱ������Ӧ��Ũ�ȣ���Ӧ�������� 8.3��10��4mol/��L��s�� 2MnO42����5H2C2O4��6H��=2Mn2����10CO2����8H2O ������ Mn2�� B 0.06
��������
���ݿ��Ʊ���������Ӱ�컯ѧ��Ӧ���ʵ����������ݲ�ͬ�����¸��������Һ��ɫ�Ŀ����̶Ȳ�ͬ���ó������Ľ��ۣ���ʵ���еIJ�������������ġ�
��ij�о���ѧϰ������H2C2O4��Һ������KMnO4��Һ֮��ķ�Ӧ��̽������������ı�Ի�ѧ��Ӧ���ʵ�Ӱ������
��1��ʵ��A��B�У����������Һ��Ũ������ͬ�ģ���H2C2O4��Һ��Ũ���Dz�ͬ�ģ���ͨ��ʵ��A��B��̽����Ũ�ȵĸı�Է�Ӧ���ʵ�Ӱ�죬���ݿ��Ʊ�����ԭ����Ҫ������ʵ����¶���ͬ����Һ���������ͬ��������V1=1��T1= 293K��ͬ����B��C��ʵ����¶Ȳ�ͬ�⣬����������ͬ����ͨ��ʵ��B��C��̽�����¶ȱ仯�Ի�ѧ��Ӧ���ʵ�Ӱ�졣
��2����t1��8����ʵ��A�ĵķ�Ӧ���ʽϴ�ʵ��A�в����Ũ�ȴ���ʵ��B������ʵ��A��B���Եó��Ľ���������������ͬʱ������Ӧ��Ũ�ȣ���Ӧ������������ʵ��B�����ݼ��㣬��Ϻ���ʼŨ��c(KMnO4)=![]() ����Һ��ɫ��ʱ8s��c(KMnO4)=0������KMnO4��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ
����Һ��ɫ��ʱ8s��c(KMnO4)=0������KMnO4��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ![]() 8.3��10��4mol/��L��s����
8.3��10��4mol/��L��s����
��3���÷�Ӧ������ɫ��ζ���������������ΪCO2���̱���ԭΪMn2+���÷�Ӧ�����ӷ���ʽΪ2MnO42����5H2C2O4��6H��=2Mn2����10CO2����8H2O��
��4����С���һλͬѧͨ���������Ϸ��֣���Ӧһ��ʱ���÷�Ӧ���ʻ�ӿ죬��ɴ��ֱ仯��ԭ���Ƿ�Ӧ��ϵ�е�ij�����Ӷ�KMnO4��H2C2O4֮��ķ�Ӧ��ij����������ã����ڷ�Ӧ����һ�����¶��½��еģ��ʷ�Ӧ��ϵ�е�ij�����ӵ���������������������Ӧ�ĸ��ֲ����Ӧ���������п�����Mn2����
II.100kPaʱ����Ӧ2NO(g)+O2(g)![]() 2NO2(g)��NO��ƽ��ת�������¶ȵĹ�ϵ������ͼ1����Ӧ2NO2(g)
2NO2(g)��NO��ƽ��ת�������¶ȵĹ�ϵ������ͼ1����Ӧ2NO2(g)![]() N2O4(g)��һ��������������ٵķ�Ӧ����NO2��ƽ��ת�������¶ȵĹ�ϵ���߿�֪���¶�Խ�ߣ�NO2��ƽ��ת����ԽС����÷�ӦΪ���ȷ�Ӧ��
N2O4(g)��һ��������������ٵķ�Ӧ����NO2��ƽ��ת�������¶ȵĹ�ϵ���߿�֪���¶�Խ�ߣ�NO2��ƽ��ת����ԽС����÷�ӦΪ���ȷ�Ӧ��
������ͬ��ѹǿ�£��¶�Խ�ߣ��ﵽƽ��ʱNO��ת����ԽС����Ӧ2NO(g)+O2(g)![]() 2NO2(g)��һ��������������ٵķ��ȷ�Ӧ�����ڸ���ϵ����ƽ��ѹǿΪ100kPa�����������ϵĵ��ѹǿ����100kPa���������ϵĵ��ѹǿС��100kPa����B���Ӧ��ѹǿ���
2NO2(g)��һ��������������ٵķ��ȷ�Ӧ�����ڸ���ϵ����ƽ��ѹǿΪ100kPa�����������ϵĵ��ѹǿ����100kPa���������ϵĵ��ѹǿС��100kPa����B���Ӧ��ѹǿ���
�� 100kPa��25��ʱ��2NO2(g)![]() N2O4(g)ƽ����ϵ�У���ͼ��֪��NO2��ƽ��ת����Ϊ80%����NO2����ʼ��Ϊ1mol������仯��Ϊ0.8mol��N2O4�ı仯��Ϊ0.4mol��NO2��N2O4��ƽ�����ֱ�Ϊ0.2mol��0.4mol����ƽ����ϵ�У�NO2��N2O4����������ֱ�Ϊ
N2O4(g)ƽ����ϵ�У���ͼ��֪��NO2��ƽ��ת����Ϊ80%����NO2����ʼ��Ϊ1mol������仯��Ϊ0.8mol��N2O4�ı仯��Ϊ0.4mol��NO2��N2O4��ƽ�����ֱ�Ϊ0.2mol��0.4mol����ƽ����ϵ�У�NO2��N2O4����������ֱ�Ϊ![]() ��
��![]() ����ˣ�ƽ�ⳣ��Kp��
����ˣ�ƽ�ⳣ��Kp��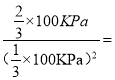 0.06��
0.06��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾ��Ӧ��ѧ��Ӧ�����ӷ���ʽ��ȷ����
A. ������Һ��KIO3��KI��Ӧ����I2��IO3��I��6H��=I2��3H2O
B. ������ͭ�缫���CuSO4 ��Һ��2Cu2+ +2H2O![]() 2Cu�� + O2�� +4H+
2Cu�� + O2�� +4H+
C. ����������Һ������������Һǡ�÷�Ӧ��������H����SO42����Ba2����OH���� H2O��BaSO4��
D. ����0.1 mol���ʵ���������ϡ��Һ�м���7.8 g Na2O2��4Na2O2��4Fe2����6H2O��4Fe(OH)3��8Na����O2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4HSO4 �ڷ����Լ���ҽҩ�����ӹ�ҵ����;�㷺������ʱ����100mL0.lmol��L-1 NH4HSO4 ��Һ�еμ�0.1mol��L-1NaOH��Һ���õ�����ҺpH ��NaOH ��Һ����Ĺ�ϵ������ͼ��ʾ������˵����ȷ����
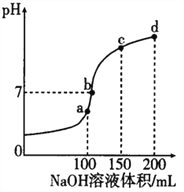
A. a����Һ����c(NH4+)+c(H+)=c(Na+) +c(OH-)
B. C����Һ����c(SO42-)>c(NH3��H2O)>c(NH4+)
C. d����Һ����c(SO42-) >c(OH-)>c(NH4+)
D. a��b��c��d �ĸ�������b��ˮ�ĵ���̶����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������»�ѧ��Ӧ��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H��0�Ļ�ѧƽ�ⳣ��K=1����ͬ�����£���c(CO2)=0.5mol/L��c(H2)=0.5mol/L��c(CO)=1mol/L��c(H2O)=1mol/Lʱ������˵����ȷ���ǣ� ��
CO(g)+H2O(g) ��H��0�Ļ�ѧƽ�ⳣ��K=1����ͬ�����£���c(CO2)=0.5mol/L��c(H2)=0.5mol/L��c(CO)=1mol/L��c(H2O)=1mol/Lʱ������˵����ȷ���ǣ� ��
A. ����ƽ��״̬�����淴Ӧ�������B. �ı�������ѧƽ�ⳣ��һ���ı�
C. ��Ӧ������У�����Ӧ����С���淴Ӧ����D. �����¶ȣ�ƽ�������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.�ں��������½�һ����X��Y�Ļ������ͨ��һ�ݻ�Ϊ2L���ܱ���������X��Y�����ʵ�Ũ����ʱ��仯�����ͼ��

��1���÷�Ӧ�Ļ�ѧ����ʽΪ (��Ӧ����������÷���X��Y��ʾ)�� _________________��
��2��a��b��c��d�ĸ����У���ʾ��ѧ��Ӧ����ƽ��״̬�ĵ���________________��
��.��3����ͼ�ǿ��淴ӦX2��3Y2 ![]() 2Z�ڷ�Ӧ�����еķ�Ӧ����(v)��ʱ�䣨t���Ĺ�ϵ���ߣ�����������ȷ����______��
2Z�ڷ�Ӧ�����еķ�Ӧ����(v)��ʱ�䣨t���Ĺ�ϵ���ߣ�����������ȷ����______��
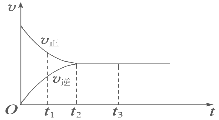
A. t1ʱ��ֻ��������Ӧ
B. t2ʱ����Ӧ�ﵽ��
C. t2��t3����Ӧ���ٷ���
D. t2��t3�������ʵ�Ũ�Ȳ��ٷ����仯
��. �����ǹ��ڻ�ѧ��Ӧ2SO2��O2![]() 2SO3�������زģ�
2SO3�������زģ�
�ز�1��ij�¶Ⱥ�ѹǿ�£�2L�����У���ͬʱ������ܱ���ϵ���������ʵ����ʵ���
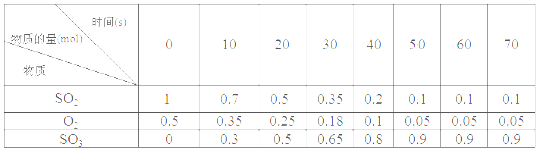
�ز�2����Ӧ�ڲ�ͬ�����½���ʱSO2��ת���ʣ�(SO2��ת�����Ƿ�Ӧ��SO2ռ��ʼSO2�İٷ�����SO2��ת����Խ��ѧ��Ӧ����Խ��)

�������ϵ������زĻش����⣺
��4�������ز�1�м���20��30 s�ڼ䣬�ö��������ʾ�Ļ�ѧ��Ӧƽ������Ϊ________��
��5�������ز�2�з����õ�����߸û�ѧ��Ӧ�ȵ�;����_______________��
��6�������ز�1���ز�2�з����õ���Ҫʵ���ز�1��SO2��ת��������Ƶķ�Ӧ����������__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҩ����θ��ƽ���к�����������������������θ�ᣨ��Ҫ�ɷ������ᣩ���ࡣ�÷�Ӧ����
A. ���Ϸ�Ӧ B. �ֽⷴӦ C. �û���Ӧ D. ���ֽⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A. ��ʯī�缫���MgCl2��Һ:Mg2++2C1-+2H2O![]() Mg(OH)2��+Cl2��+H2��
Mg(OH)2��+Cl2��+H2��
B. ��������Һ�еμ�̼������Һ:2Al3++3CO32-==Al2(CO3)3��
C. ��Ca(HCO3)2��Һ�еμ�����NaOH��Һ:Ca2++2HCO3-+2OH-==CaCO3��+CO32-+2H2O
D. ��Fe(NO3)3��Һ�м��������HI��Һ:2NO3-+8H++6I-==3I2+2NO��+4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�������������ʵ���������
A. ������Mg��0.5mol��L��1��ϡ����200mL
B. ������Cu��5mol��L��1������400mL
C. ������Al��0.3mol��L��1������������Һ200mL
D. ������Mg��0.5mol��L��1��ϡ����200mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ�ѧ����ʽ��
��Fe2O3(s)��3CO(g)= 2Fe(s)��3CO2(g) ��H1����26.7 kJ��mol��1
��3Fe2O3(s)��CO(g)= 2Fe3O4(s)��CO2(g) ��H2����50.75 kJ��mol��1
��Fe3O4(s)��CO(g)= 3FeO(s)��CO2(g) ��H3����36.5 kJ��mol��1
����ͨ�������жϣ������йط�ӦFeO(s)��CO(g)=Fe(s)��CO2(g)�������仯ʾ��ͼ��ȷ����

A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com