
【题目】下列表示对应化学反应的离子方程式正确的是
A. 酸性溶液中KIO3与KI反应生成I2:IO3+I+6H+=I2+3H2O
B. 用两个铜电极电解CuSO4 溶液:2Cu2+ +2H2O![]() 2Cu↓ + O2↑ +4H+
2Cu↓ + O2↑ +4H+
C. 硫酸氢钠溶液与氢氧化钡溶液恰好反应呈中性:H++SO42-+Ba2++OH-= H2O+BaSO4↓
D. 向含有0.1 mol溶质的硫酸亚铁稀溶液中加入7.8 g Na2O2:4Na2O2+4Fe2++6H2O=4Fe(OH)3+8Na++O2↑
【答案】D
【解析】
A.电荷不守恒,酸性溶液中KIO3与KI反应的离子方程式为:IO3+5I+6H+=3I2+3H2O,故A错误;
B.用两个铜电极电解CuSO4溶液时,阳极为铜本身失电子变成铜离子,阴极为溶液中的铜离子得到电子变成铜单质,没有水参与电解,故B错误;
C.硫酸氢钠溶液与氢氧化钡溶液恰好反应呈中性,硫酸氢钠溶液与氢氧化钡按照物质的量2:1反应,反应的离子方程式为:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓,故C错误;
D.过氧化钠与水反应生成氢氧化钠和氧气,氧气氧化亚铁离子为三价铁离子,和氢氧化钠生成氢氧化铁沉淀,向含有0.1 mol溶质的硫酸亚铁稀溶液中加入7.8gNa2O2,7.8gNa2O2的物质的量为0.1mol,亚铁离子与过氧化钠等物质的量反应,离子方程式为:4Na2O2+4Fe2++6H2O=4Fe(OH)3+8Na++O2↑,故D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】下列有关除杂质(括号中为杂质)的试剂及操作中,不正确的是
A.乙烷(乙烯):溴水,洗气B.乙醇(水):蒸馏
C.乙酸乙酯(乙酸):饱和碳酸钠溶液,分液D.溴苯(溴):氢氧化钠溶液,分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把5.6g的Fe放入足量稀硫酸中,Fe完全反应。计算:
(1)5.6gFe的物质的量_________;
(2)生成H2的体积(标准状况)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行如下实验,研究化学反应中的热量变化。
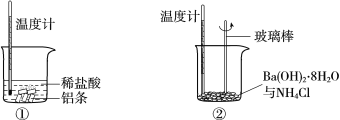
请回答下列问题:
(1)反应后①中温度升高,②中温度降低。由此判断铝条与盐酸的反应是________反应(填“放热”或“吸热”,下同),Ba(OH)2·8H2O与NH4Cl的反应是________反应。
(2)①中反应的离子方程式是_________,该反应的还原剂是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2溶于水后,与水反应生成H2SO3,下列对于H2SO3的性质预测正确的是( )
A.有氧化性,无还原性,无酸性
B.有氧化性,有还原性,有酸性
C.有还原性,无氧化性,无酸性
D.有还原性,无氧化性,有酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Ⅲ是合成中药黄芩中的主要活性成分的中间体,合成方法如下:
 +HCl
+HCl
下列有关叙述正确的是
A.I的分子式为C9H10O4
B.II中所有原子有可能均共面
C.可用FeCl3溶液鉴别有机物I和III
D.1 mol产物III与足量溴水反应,消耗Br2的物质的量为1.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓度均为0.01 mol/L 的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
(资料)
该“碘钟实验”的总反应:H2O2 +2S2O32-+2H+=S4O62-+2H2O
反应分两步进行:
反应A:H2O2+2I-+2H+=I2+2H2O
反应B:……
(1)反应B的离子方程式是______。对于总反应,I-的作用相当于______。
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是______。
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ。(溶液浓度均为0.01 mol/L)
试剂 序号 用量(mL) | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | KI溶液 (含淀粉) | H2O |
实验Ⅱ | 5 | 4 | 8 | 3 | 0 |
实验Ⅲ | 5 | 2 | x | y | z |
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是30 min、实验Ⅲ是40 min。
①实验Ⅲ中,x、y、z所对应的数值分别是______。
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是______。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ。
(溶液浓度均为0.01 mol/L)
试剂 序号 用量(mL) | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | KI溶液(含淀粉) | H2O |
实验Ⅳ | 4 | 4 | 9 | 3 | 0 |
实验过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验Ⅳ未产生颜色变化的原因:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KNO3是重要的化工产品,下面是一种已获得专利的KNO3制备方法的主要步骤:
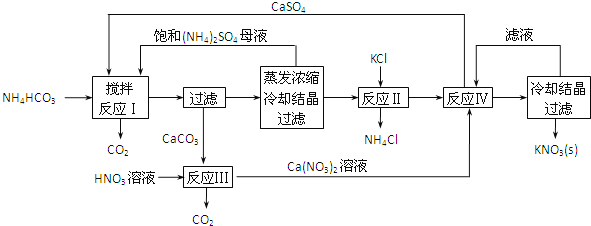
(1)反应Ⅰ中,CaSO4与NH4HCO3的物质的量之比为1:2,该反应的化学方程式为____________。
(2)反应Ⅱ需在干态、加热的条件下进行,加热的目的是____________;从反应Ⅳ所得混合物中分离出CaSO4的方法是趁热过滤,趁热过滤的目的是____________。
(3)检验反应Ⅱ所得K2SO4中是否混有KCl的方法是:取少量K2SO4样品溶解于水,____________。
(4)整个流程中,可循环利用的物质除(NH4)2SO4外,还有____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
实验序号 | 实验温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
V(mL) | C(mol/L) | V(mL) | C(mol/L) | V(mL) | t(s) | ||
A | 293K | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313K | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出_______的改变对反应速率的影响,其中V1=_____,T1=_____,通过实验_______可探究出温度变化对化学反应速率的影响。
(2)若t1<8,则由实验A、B可以得出的结论是________________________span>;利用实验B中数据计算,从反应开始到有结束,用KMnO4的浓度变化表示的反应速率为____________。
(3)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式_______。
(4)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是_______________,相应的粒子最有可能是(填符号)_______。
II.100kPa时,反应2NO(g)+O2(g)![]() 2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)
2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)![]() N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
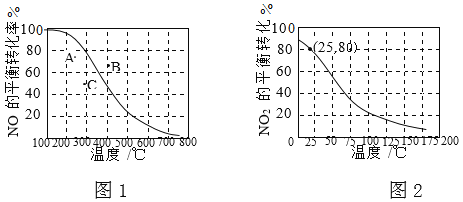
① 图1中A、B、C三点表示不同温度、压强下2NO(g)+O2(g)![]() 2NO2(g)达到平衡时NO的转化率,则________点对应的压强最大。
2NO2(g)达到平衡时NO的转化率,则________点对应的压强最大。
② 100kPa、25℃时,2NO2(g)![]() N2O4(g)平衡体系中,列式计算平衡常数Kp=________。(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
N2O4(g)平衡体系中,列式计算平衡常数Kp=________。(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com