
【题目】SO2溶于水后,与水反应生成H2SO3,下列对于H2SO3的性质预测正确的是( )
A.有氧化性,无还原性,无酸性
B.有氧化性,有还原性,有酸性
C.有还原性,无氧化性,无酸性
D.有还原性,无氧化性,有酸性
科目:高中化学 来源: 题型:
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10﹣5 |
下列说法不正确的是
A. 上述生成Ni(CO)4(g)的反应为放热反应
B. 25℃时反应Ni(CO)4(g)![]() Ni(s)+4CO(g)的平衡常数为2×10﹣5
Ni(s)+4CO(g)的平衡常数为2×10﹣5
C. 在80℃时,测得某时刻,Ni(CO)4(g)、CO浓度均为0.5 mol/L,则此时v(正)>v(逆)
D. 80℃达到平衡时,测得n(CO)=0.15mol,则Ni(CO)4的平衡浓度为0.125 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(铝热剂并不单指Fe2O3与铝粉的混合物,实际上铝粉可以与许多金属氧化物配成铝热剂。如铝粉与Fe3O4或MnO2等均可发生铝热反应。
(1)写出上述铝热反应的化学方程式:①_______________;②_________________________;
(2)据上述反应可总结出铝热反应的特点:①铝热反应实际上属于四大基本反应类型中的________,其中铝表现了其__________性,作______剂;②铝热反应常用于冶炼金属性比铝__________(填“强”或“弱”)的金属。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实与相应结论不正确的是
选项 | 实验事实 | 结论 |
A | 其他条件不变,0.01 mol·L-1的酸性KMnO4溶液分别与0.1 mol·L-1的H2C2O4溶液和0.2 mol·L-1的H2C2O4溶液反应,后者褪色时间短 | 当其他条件不变时,增大反应物浓度可以使化学反应速率加快 |
B | 其他条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和H2SO4混合液放在冷水和热水中,放在热水中的混合液先出现浑浊 | 当其他条件不变时,反应体系的温度越高,化学反应速率越快 |
C | 将少量MnO2粉末加入盛有10%双氧水的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生改变 | 催化剂虽然可以加快化学反应的速率,但一定不参与化学反应过程 |
D | 一定条件下,分别在容积为1 L和容积为2 L的两个密闭容器中加入等量的氢气和碘蒸气,发生如下反应:H2(g)+I2(g) | 当其他条件不变时,气态反应体系的压强越大,化学反应速率越快 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四川抗震救灾中,芦山县一存放漂白粉的仓库因漏雨而引发爆炸,冒出大量有毒的浓烟,周围的居民被迅速疏散。下列关于漂白粉的叙述不正确的是( )
A.漂白粉是由氯气通氢氧化钠溶液中制得的
B.漂白粉要密封保存在干燥处
C.漂白粉可用于杀菌消毒
D.漂白粉的主要成分是次氯酸钙和氯化钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A. 酸性溶液中KIO3与KI反应生成I2:IO3+I+6H+=I2+3H2O
B. 用两个铜电极电解CuSO4 溶液:2Cu2+ +2H2O![]() 2Cu↓ + O2↑ +4H+
2Cu↓ + O2↑ +4H+
C. 硫酸氢钠溶液与氢氧化钡溶液恰好反应呈中性:H++SO42-+Ba2++OH-= H2O+BaSO4↓
D. 向含有0.1 mol溶质的硫酸亚铁稀溶液中加入7.8 g Na2O2:4Na2O2+4Fe2++6H2O=4Fe(OH)3+8Na++O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-)
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O) > c(NH4+)> c(Cl-)> c(OH-)
C.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
D.0.1 mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合:![]() c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C3H8是一种常用燃料,下列关于这种燃料说法正确的是( )
A.常温常压下为液体
B.与1-丁烯互为同分异构体
C.分子中所有原子共平面,一氯代物有5种
D.1 mol这种燃料完全燃烧需5 mol氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图。

(1)该反应的化学方程式为 (反应物或生成物用符号X、Y表示): _________________。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的点是________________。
Ⅱ.(3)如图是可逆反应X2+3Y2 ![]() 2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是______。
2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是______。
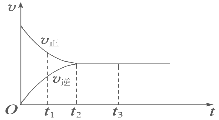
A. t1时,只有正方向反应
B. t2时,反应达到限度
C. t2~t3,反应不再发生
D. t2~t3,各物质的浓度不再发生变化
Ⅲ. 以下是关于化学反应2SO2+O2![]() 2SO3的两个素材:
2SO3的两个素材:
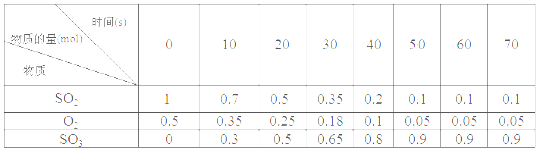
素材1:某温度和压强下,2L容器中,不同时间点测得密闭体系中三种物质的物质的量
素材2:反应在不同条件下进行时SO2的转化率:(SO2的转化率是反应的SO2占起始SO2的百分数,SO2的转化率越大,化学反应的限度越大)

根据以上的两个素材回答问题:
(4)根据素材1中计算20~30 s期间,用二氧化硫表示的化学反应平均速率为________。
(5)根据素材2中分析得到,提高该化学反应限度的途径有_______________。
(6)根据素材1、素材2中分析得到,要实现素材1中SO2的转化率需控制的反应具体条件是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com