
【题目】把5.6g的Fe放入足量稀硫酸中,Fe完全反应。计算:
(1)5.6gFe的物质的量_________;
(2)生成H2的体积(标准状况)_________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的转化,一定要加入氧化剂才能完成的是
A. Cl2 → NaCl B. H2O2 → O2
C. Fe → FeCl3 D. K2CO3 → KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl-、CO32-、OH- 3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序中,正确的是
①滴加Ba(NO3)2溶液; ②过滤; ③滴加Mg(NO3)2溶液; ④滴加AgNO3溶液
A. ①②④②③ B. ④②①②③
C. ①②③②④ D. ④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(铝热剂并不单指Fe2O3与铝粉的混合物,实际上铝粉可以与许多金属氧化物配成铝热剂。如铝粉与Fe3O4或MnO2等均可发生铝热反应。
(1)写出上述铝热反应的化学方程式:①_______________;②_________________________;
(2)据上述反应可总结出铝热反应的特点:①铝热反应实际上属于四大基本反应类型中的________,其中铝表现了其__________性,作______剂;②铝热反应常用于冶炼金属性比铝__________(填“强”或“弱”)的金属。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 硫酸、纯碱(Na2CO3)、氯化钠和生石灰分别属于酸、碱、盐和碱性氧化物
B. 用丁达尔效应可区别FeCl3溶液和Fe(OH)3胶体
C. 生石灰与水混合的过程只发生物理变化
D. H2O、C2H5OH、SO3均含有氧元素,都是氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实与相应结论不正确的是
选项 | 实验事实 | 结论 |
A | 其他条件不变,0.01 mol·L-1的酸性KMnO4溶液分别与0.1 mol·L-1的H2C2O4溶液和0.2 mol·L-1的H2C2O4溶液反应,后者褪色时间短 | 当其他条件不变时,增大反应物浓度可以使化学反应速率加快 |
B | 其他条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和H2SO4混合液放在冷水和热水中,放在热水中的混合液先出现浑浊 | 当其他条件不变时,反应体系的温度越高,化学反应速率越快 |
C | 将少量MnO2粉末加入盛有10%双氧水的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生改变 | 催化剂虽然可以加快化学反应的速率,但一定不参与化学反应过程 |
D | 一定条件下,分别在容积为1 L和容积为2 L的两个密闭容器中加入等量的氢气和碘蒸气,发生如下反应:H2(g)+I2(g) | 当其他条件不变时,气态反应体系的压强越大,化学反应速率越快 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A. 酸性溶液中KIO3与KI反应生成I2:IO3+I+6H+=I2+3H2O
B. 用两个铜电极电解CuSO4 溶液:2Cu2+ +2H2O![]() 2Cu↓ + O2↑ +4H+
2Cu↓ + O2↑ +4H+
C. 硫酸氢钠溶液与氢氧化钡溶液恰好反应呈中性:H++SO42-+Ba2++OH-= H2O+BaSO4↓
D. 向含有0.1 mol溶质的硫酸亚铁稀溶液中加入7.8 g Na2O2:4Na2O2+4Fe2++6H2O=4Fe(OH)3+8Na++O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4HSO4 在分析试剂、医药、电子工业中用途广泛。室温时,向100mL0.lmol·L-1 NH4HSO4 溶液中滴加0.1mol·L-1NaOH溶液,得到的溶液pH 与NaOH 溶液体积的关系曲线如图所示。下列说法正确的是
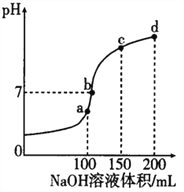
A. a点溶液中:c(NH4+)+c(H+)=c(Na+) +c(OH-)
B. C点溶液中:c(SO42-)>c(NH3·H2O)>c(NH4+)
C. d点溶液中:c(SO42-) >c(OH-)>c(NH4+)
D. a、b、c、d 四个点中,b点水的电离程度最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com