
����Ŀ��I.����һƿ��ɫ������Һ��������Na+��K+��NH4+��Fe2+��SO42-��I-��CO32-��Cl-��SO32-��MnO4-�еļ�����ɣ����������ʵ�鲽�輰����ش��������⣺
����һ��ȡ��������Һ������NaOH��Һ�����ȣ��õ���ҺA���������̼�����ζ�����壻
�����������ҺA�м�������ϡ�����BaCl2��Һ���õ���ҺB����ɫ�������д̼�����ζ�����壻
������������ҺB��ͨ������Cl2���õ��ƺ�ɫ��ҺC��
(1)�����йظ���Һ˵����ȷ����________________(����ĸ)��
A һ������SO42-��I-��NH4+��SO32- B һ��������Fe2+��CO32-��MnO4-
C ���ܴ���CO32-��Cl-��Na+��K+�� D ����AgNO3��Һȷ��ԭ��Һ���Ƿ����Cl-
(2)�������õ��ƺ�ɫ��Һ�����ӷ���ʽ��____________________��
(3)����ԭ��Һ���ȼ������������ᣬ�ټ���������______________(�ѧʽ)�����ȣ�Ҳ�ܵó�����һ���������ͬ�Ľ��ۡ�
(4)������Һ�л����ܴ��ڵ������ӣ�ȷ������ڵ�ʵ�鷽����__________________��
II.��һ��������ͭƬ��25.0 mL 18.0 mol��L��1��Ũ�����ڼ���������ַ�Ӧ������ͭƬ���������ʣ�ࡣ�ٶ���Ӧǰ����Һ��������䣬��ʣ�������Ũ��Ϊd mol��L��1������Ӧ����Һ�л�����������ع��壬��ֽ���ֱ��ʣ��ͭƬǡ����ȫ��Ӧ����Ӧ���������____________mol(�ú�d�Ĵ���ʽ��ʾ)��
���𰸡�AC Cl2+2I-=I2+2Cl- Ba(OH)2 ͨ����ɫ��Ӧ�������ֻ�ɫ������Na+������ɫ�ܲ���Ƭ�۲���ɫ��Ӧ����������ɫ����K+ d/80��0.0125d ��1.25��10-2d
��������
��Ϊ��Һ������ɫ���ģ�������Һ![]() ��û��Fe2+��MnO4-������NaOH��Һ�����ȣ������Ĵ̼�����ζ������Ӧ��NH3��˵��ԭ��Һ����NH4+������������ϡ���ᣬ���Ƚ�������NaOH�к͵�����ɫ����BΪ���������BaSO4������˵��ԭ��Һ�к���SO42-�������̼�����ζ������Ӧ��SO2��˵��ԭ��Һ�к���SO32-������ҺB��ͨ��Cl2���õ��Ļƺ�ɫ��ҺC��Ӧ����I2��˵��ԭ��Һ�к���I-���ۺ������ƶϣ���ƿ��ɫ������Һ�У�һ������NH4+��SO42-��SO32-��I-��һ��û��Fe2+��MnO4-�����ܺ���Na+��K+��CO32-��
��û��Fe2+��MnO4-������NaOH��Һ�����ȣ������Ĵ̼�����ζ������Ӧ��NH3��˵��ԭ��Һ����NH4+������������ϡ���ᣬ���Ƚ�������NaOH�к͵�����ɫ����BΪ���������BaSO4������˵��ԭ��Һ�к���SO42-�������̼�����ζ������Ӧ��SO2��˵��ԭ��Һ�к���SO32-������ҺB��ͨ��Cl2���õ��Ļƺ�ɫ��ҺC��Ӧ����I2��˵��ԭ��Һ�к���I-���ۺ������ƶϣ���ƿ��ɫ������Һ�У�һ������NH4+��SO42-��SO32-��I-��һ��û��Fe2+��MnO4-�����ܺ���Na+��K+��CO32-��
I����1��A����ȷ����������������������������һ�����ڣ�B�����������ϡ����������������֤��CO32-�Ƿ���ڣ�C����ȷ�����������������ж��Ƿ���ڣ�D���������Һ����I-��SO32-��SO42-(�������ܺ��е�CO32-)������Ag+��Ӧ���ɰ�ɫ���������Ե���AgNO3��Һ����������Һ���Ƿ���Cl-������Ҫ�ټ��������ϡ���
��2���������з�����������I-�ķ�Ӧ��Cl2+2I-=2Cl-+I2��
��3������һ�Ͳ�����������NH4+��SO42-��SO32-��û�м���CO32-�����ȼ������������ᣬ����ͨ�������̼�����ζ�����壬ȷ��SO32-�Ĵ��ڣ�����ȥ��SO32-�Ϳ����е�CO32-��Ҫ���NH4+���϶���ҪOH-��Ҫ���SO42-������ҪBa2+������ѡ���ټ�����������Լ�ΪBa(OH)2��Һ��
��4����ѧ�м��Na+��K+�Ĵ��ڣ�ͨ����ͨ����ɫ��Ӧ�������ɫ��Ӧ�ʻ�ɫ��˵����Һ����Na+���������ɫ�ܲ����۲쵽dz��ɫ��˵����Һ����K+��
II��ʣ��������Һ����������ʵ���Ϊ0.025d mol����H+�����ʵ���Ϊ0.05mol������KNO3��ʣ���ͭƬǡ����ȫ��Ӧ����ʱ��Һ�е�����Ҳǡ����ȫ��Ӧ����Ŀ������ܹ�˵������Ȼ�����㣩����ʱ�൱����Һ���������ᣬ��ʱͭƬ�����ܽ⣬������Ӧ��
3Cu+8H++2NO3-=3Cu2++2NO��+4H2O
8 2
0.05d n(NO3-)
![]() �����n(NO3-)=
�����n(NO3-)=![]() mol������KNO3�����ʵ���Ϊ
mol������KNO3�����ʵ���Ϊ![]() mol��
mol��


 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������»�ѧ��Ӧ��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H��0�Ļ�ѧƽ�ⳣ��K=1����ͬ�����£���c(CO2)=0.5mol/L��c(H2)=0.5mol/L��c(CO)=1mol/L��c(H2O)=1mol/Lʱ������˵����ȷ���ǣ� ��
CO(g)+H2O(g) ��H��0�Ļ�ѧƽ�ⳣ��K=1����ͬ�����£���c(CO2)=0.5mol/L��c(H2)=0.5mol/L��c(CO)=1mol/L��c(H2O)=1mol/Lʱ������˵����ȷ���ǣ� ��
A. ����ƽ��״̬�����淴Ӧ�������B. �ı�������ѧƽ�ⳣ��һ���ı�
C. ��Ӧ������У�����Ӧ����С���淴Ӧ����D. �����¶ȣ�ƽ�������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�������������ʵ���������
A. ������Mg��0.5mol��L��1��ϡ����200mL
B. ������Cu��5mol��L��1������400mL
C. ������Al��0.3mol��L��1������������Һ200mL
D. ������Mg��0.5mol��L��1��ϡ����200mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijϡ��Һ�к���4 mol KNO3��2.5 mol H2SO4�������м���1.5 mol Fe����ַ�Ӧ����֪NO3������ԭΪNO����������Һ���Ϊ1L������˵����ȷ����
A. ������Һ��c(NO3��)��2.75 mol��L��1
B. ������Һ��c(Fe2��)��c(Fe3��)��1��2
C. ��Ӧ������NO�����Ϊ33.6 L����״���£�
D. ������Һ�е�����ֻ��FeSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ����������,���ֶ�����Ԫ��(����ĸ��ʾ)ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯����ͼ��ʾ��
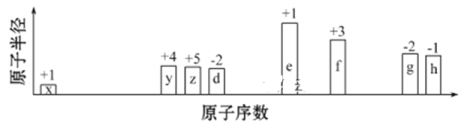
�����жϳ���Ԫ�ػش�����:
(1) f�����ڱ��е�λ����__________��
(2) �Ƚ�d��e�������ӵİ뾶��С(�û�ѧʽ��ʾ,��ͬ):____>____;�Ƚ�g��h������������Ӧˮ���������ǿ��:____>____��
(3) ��ѡ����Ԫ�����һ����ԭ�ӹ��ۻ�����,д�������ʽ:____��
(4)f��h�γɵĻ�������������ʷdz����⣬����۵�Ϊ190��(2.02��105Pa)������180��Ϳ�ʼ�������ݴ��жϣ��û�������_______(�������ۻ��������������ӻ�������) , ����֤������ж���ȷ��ʵ��������________________��
(5) ����Ԫ�ؿ������R: zx4f(gd4)2����ʢ��10 mL 1 mol��L-1R��Һ���ձ��еμ�1 mol��L-1NaOH��Һ,�������ʵ�����NaOH��Һ����ı仯ʾ��ͼ����:
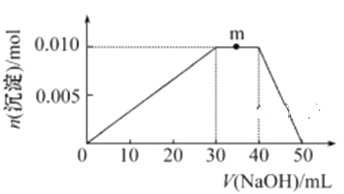
��m�㷴Ӧ�����ӷ���ʽ: ________________��
������R��Һ�иļ�20 mL 1.2 mol��L��1Ba(OH)2��Һ,��ַ�Ӧ��,��Һ�в������������ʵ���Ϊ_______mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������4���л����CH4 ��CH2��CH2 ��CH3CH2CH2CH3 ��CH3CH2OH ��������
��1����ٻ�Ϊͬϵ�����______������ţ���
��2��д���ܵĹ���������Ϊ _________________ ��
��3��д���۵�ͬ���칹��Ľṹ��ʽ_______��
��4��д���۵Ķ��ȴ�����____________��.
��5������ͨ����ָ������Һ��_________�ĺ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ�ѧ����ʽ��
��Fe2O3(s)��3CO(g)= 2Fe(s)��3CO2(g) ��H1����26.7 kJ��mol��1
��3Fe2O3(s)��CO(g)= 2Fe3O4(s)��CO2(g) ��H2����50.75 kJ��mol��1
��Fe3O4(s)��CO(g)= 3FeO(s)��CO2(g) ��H3����36.5 kJ��mol��1
����ͨ�������жϣ������йط�ӦFeO(s)��CO(g)=Fe(s)��CO2(g)�������仯ʾ��ͼ��ȷ����

A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ٵ����������̼���������ڴ����е��ŷ��ǻ�����������Ҫ����֮һ������Ӧ�úʹ���̼�������仯�������������������Ҫ���塣
(1)���������������̼���о�һֱ�ǿƼ����ע���ص㡣�ڴ�����������H2��ԭCO2 �ǽ������ЧӦ����Ҫ�ֶ�֮һ,��ط�Ӧ����:
��֪H2 ��CH4��ȼ���ȷֱ�Ϊ285.5kJ/mol ��890.0kJ/mol��
H2O(1) =H2O(g) ��H= +44 kJ/mol
��д��H2 ��ԭCO2 ����CH4��H2O(g)���Ȼ�ѧ����ʽ_____________��
(2)CO2��Cu-ZnO����,��ͬʱ�������µķ�ӦI��II�������Ϊ�������ЧӦ����Դ��ȱ����Ҫ�ֶΡ�
I.CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) ��H1=-57.8 kJ/mol
CH3OH(g) +H2O(g) ��H1=-57.8 kJ/mol
II.CO2(g) +H2(g)![]() CO(g) + H2O(g) ��H2 = +41.2 kJ/mol
CO(g) + H2O(g) ��H2 = +41.2 kJ/mol
��ij�¶�ʱ������ӦI���ٶ�v1���ڷ�ӦII���ٶ���v2,�����з�Ӧ���̵������仯��ȷ����_______(��ѡ��)��
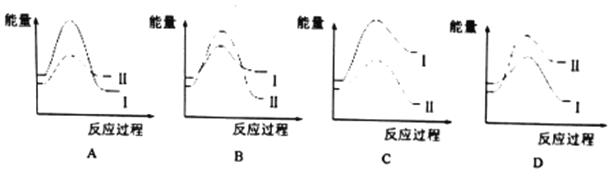
�ڶ�������μӵķ�Ӧ,����ʾƽ�ⳣ��Kpʱ,���������(B)��ƽ���ѹp(B)������������ʵ���Ũ��c(B)��
��֪:�������ֵķ�ѹp(B)��������ѹ���������������
��Cu-ZnO���ڵ������£������¶�Tʱ�����ݻ�������ܱ�������,����һ������CO2 ��H2����ʼ����ƽ��ʱ�������ڸ��������ʵ������±�:
CO2 | H2 | CH3OH | CO | H2O(g) | ��ѹ/kPa | |
��ʼ/mol | 5.0 | 7.0 | 0 | 0 | 0 | p0 |
ƽ��/mol | n1 | n2 | p |
����ӦI��II����ƽ��ʱ,P0=1.2p�������n1=____������ʱ
(3)����β���������γɵ�ԭ��֮һ���о���������Ĵ�����������Ч�����������γɣ��ɲ���������ԭ������:
4NO(g) +4NH3(g) +O2(g) ![]() 4N2(g) +6H2O(g) ��H <0
4N2(g) +6H2O(g) ��H <0
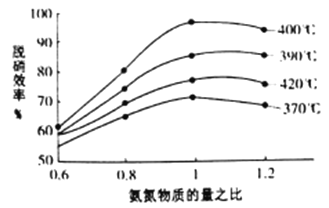
������ͼ�ж��������Ч�ʵ����������________;������һ��ʱ,��400��ʱ,����Ч�����,����ܵ�ԭ����______________��
(4)�û���̿��ԭ��Ҳ���Դ�����������,ij�о�С����ij�ܱ���������һ�����Ļ���̿��NO,������Ӧ:C(s) +2NO(g)![]() N2(g) +CO2(g) ��H>0
N2(g) +CO2(g) ��H>0
��T��ʱ,��Ӧ���е���ͬʱ���ø����ʵ���Ũ������:
ʱ��/min Ũ��/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
30min��,ֻ�ı�ijһ����,�����ϱ��������жϸı������������_______��
A.ͨ��һ������CO2 B.������ʵĴ��� C.�ʵ���С���������
D.ͨ��һ������NO E.����һ�����Ļ���̿ F.�ʵ������¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�ӦX(g)��Y(g)![]() 2Z(g) ��H��0������Ӧ��ʼ��t1��ﵽƽ�⣬�־�t2�����ڷ�Ӧ�����ĸı�ʹƽ���ƻ�����t3ʱ�ִ�ƽ��(��ͼ��ʾ)��t2��t3���߱仯��ԭ����
2Z(g) ��H��0������Ӧ��ʼ��t1��ﵽƽ�⣬�־�t2�����ڷ�Ӧ�����ĸı�ʹƽ���ƻ�����t3ʱ�ִ�ƽ��(��ͼ��ʾ)��t2��t3���߱仯��ԭ����
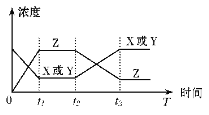
A. ������X��Y��Ũ��
B. ʹ���˴���
C. �����˷�Ӧ��ϵ��ѹǿ
D. �����˷�Ӧ���¶�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com