
【题目】今有反应X(g)+Y(g)![]() 2Z(g) △H<0,若反应开始经t1后达到平衡,又经t2后由于反应条件的改变使平衡破坏,到t3时又达平衡(如图所示),t2~t3曲线变化的原因是
2Z(g) △H<0,若反应开始经t1后达到平衡,又经t2后由于反应条件的改变使平衡破坏,到t3时又达平衡(如图所示),t2~t3曲线变化的原因是
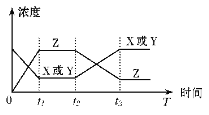
A. 增大了X或Y的浓度
B. 使用了催化剂
C. 增加了反应体系的压强
D. 升高了反应的温度
科目:高中化学 来源: 题型:
【题目】I.现有一瓶无色澄清溶液,可能由Na+、K+、NH4+、Fe2+、SO42-、I-、CO32-、Cl-、SO32-、MnO4-中的几种组成,请根据以下实验步骤及现象回答下列问题:
步骤一:取适量待测液,加入NaOH溶液并加热,得到溶液A,并产生刺激性气味的气体;
步骤二:向溶液A中加入足量稀盐酸和BaCl2溶液,得到溶液B、白色沉淀及有刺激性气味的气体;
步骤三:向溶液B中通入适量Cl2,得到黄褐色溶液C。
(1)下列有关该溶液说法正确的是________________(填字母)。
A 一定存在SO42-、I-、NH4+、SO32- B 一定不存在Fe2+、CO32-、MnO4-
C 可能存在CO32-、Cl-、Na+、K+、 D 可用AgNO3溶液确认原溶液中是否存在Cl-
(2)步骤三得到黄褐色溶液的离子方程式是____________________。
(3)若向原溶液中先加入足量的盐酸,再加入足量的______________(填化学式)并加热,也能得出步骤一、步骤二相同的结论。
(4)对于溶液中还可能存在的阳离子,确认其存在的实验方法是__________________。
II.用一定质量的铜片和25.0 mL 18.0 mol·L-1的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为d mol·L-1,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾____________mol(用含d的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
A. 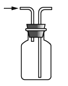 收集 NOB.
收集 NOB.  制备 NH3
制备 NH3
C.  制备 Fe(OH)2D.
制备 Fe(OH)2D. 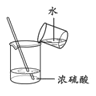 稀释浓 H2SO4
稀释浓 H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年11月在法国凡尔赛召开的国际计量大会( General Conference on Weights and Measures,CGPM)第26次会议将阿伏加德罗常数的定义修改为“1摩尔包含6.02214076×1023个基本单元,这常数被称为阿伏加德罗常数,单位为mol-1”。基于这一新定义,阿伏加德罗常数的不确定度被消除了。新定义将于2019年5月20日正式生效。NA为阿伏加德罗常数的值。下列说法错误的是
A. 22.4L(标准状况)氖气含有的电子数为10NA
B. 0.4 moI NH3与0.6mo1O2在催化剂的作用下充分反应,得到NO的分子数为0.4NA
C. 27g铝中加入足量1mol·L-1的NaOH溶液,转移的电子数为3NA
D. 常温常压下,水蒸气通过Na2O2使其增重2g时,反应中转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的Ba(OH)2溶液中,OH-的物质的量浓度为0.01mol/L。向其中逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液中OH-的物质的量浓度为0.001mol/L。
(1)该Ba(OH)2溶液中Ba(OH)2的物质的量浓度为__________________。
(2)Ba2+恰好完全沉淀时,发生反应的离子方程式为_______________________。
(3)若反应后溶液的体积等于Ba(OH)2和NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是__________。
(4)如向NaHSO4溶液中逐渐加入Ba(OH)2溶液至中性,则发生反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A(g) ![]() B(g) + D(g)在四种不同的条件下进行,B、D起始浓度为0,反应物A的浓度随反应时间的变化情况如下表:
B(g) + D(g)在四种不同的条件下进行,B、D起始浓度为0,反应物A的浓度随反应时间的变化情况如下表:
实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
(1) | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
(2) | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
(3) | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
(4) | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,下列说法错误的是
A. 在(1)中,反应在10~20 min内A的平均速率为0.013 mol/(L·min)
B. 在(2)中,A的初始浓度c2<1.0 mol/L
C. 设(3)的反应速率为υ3,(1)的反应速率为υ1,则υ3 > υ1
D. 比较(1)和(4),可推测该反应的正反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5 mol Na2CO3中含有_____个Na+。
(2)等质量的HCl、NH3、CO2、O2四种气体,在相同温度和相同压强条件下,体积最大的是_______。
(3)实验室需要0.50mol·L—1NaCl溶液480mL。
①配制溶液时必需的仪器有:托盘天平(精确到0.1)、药匙、烧杯、玻璃棒、______、胶头滴管以及等质量的几片滤纸。
②配制该溶液需称取NaCl晶体的质量为_______。
③下列操作会使所配溶液浓度偏低的是________。
A 容量瓶洗涤干净后未干燥
B 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
C 定容时俯视刻度线
D 烧杯和玻璃棒未洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列行为中符合安全要求的是
A. 进入煤矿井时,用火把照明
B. 节日期间,在开阔的广场燃放烟花爆竹
C. 用点燃的火柴在液化气钢瓶口检验是否漏气
D. 实验时,将水倒入浓硫酸配制稀硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com