
【题目】回答下列问题:
(1)下图为四种粒子的结构示意图,完成以下填空:
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
属于阳离子结构的粒子是________(填字母序号,下同);A粒子的半径________B粒子的半径(填“>”、“<”或“=”)。
(2)有机物M经过太阳光光照可转化成N,转化过程如下:

![]()
 ΔH = +88.6 kJ·mol-1
ΔH = +88.6 kJ·mol-1
则M、N相比,较稳定的是____________。
(3) 由氢气和氧气反应生成1 mol水蒸气放出热量241.8 kJ,写出该反应的热化学方程式为:_____________________________________________________。
(4)一定温度下在某定容容器中发生反应:2A(g)+3B(g)![]() 2C(g),开始时,A的浓度为2 mol·L-1,B的浓度为4 mol·L-1,2 min后,A的浓度减少0.8 mol·L-1,则
2C(g),开始时,A的浓度为2 mol·L-1,B的浓度为4 mol·L-1,2 min后,A的浓度减少0.8 mol·L-1,则
① v(B)=____________,v(C)=__________。
② 在2 min末,C的浓度是__________,B的浓度是____________。
【答案】(1)B > (2) M (3)H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
(4)①v(B)=0.6mol/(L.min),v(C)=0.4 mol/(L.min);②c(C)=0.8mol/L,n(B)=2.8mol/L
【解析】
试题分析:(1)A表示F-,B表示Mg2+,C表示Na原子,D表示Al原子,故属于阳离子结构的离子是B,A和B具有相同的核外电子排布,因此核电荷数越大,半径越小,故A的半径>B的半径;
(2)物质的能量越高,越不稳定。由于M吸收热量生成N,因此N的能量高于M,故M更稳定;
(3)由氢气和氧气反应生成1 mol水蒸气放出热量241.8 kJ,对应的热化学方程式为:H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1;
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1;
(4)①
2A(g)+3B(g)![]() 2C(g)
2C(g)
起始浓度(mol·L-1) 2 4 0
转化浓度(mol·L-1) 0.8 1.2 0.8
2min末浓度(mol·L-1) 1.2 2.8 0.8
![]() ;
;
![]() ;
;
②2min末,C的浓度为0.8 mol·L-1,B的浓度为2.8 mol·L-1。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸发生酯化反应的产物。右图为苯氧乙酸的结构简式。
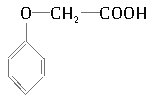
(1)甲一定含有的官能团的名称是___________________。
(2)5.8 g甲完全燃烧可产生0.3 mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不
含甲基,且为链状结构,其结构简式是______________(碳碳双键上连有羟基的结构不稳定)
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上有两种一硝基取代物的同分异构体是(写出任意两种的结构简式)____________________ ________________
(4)已知:
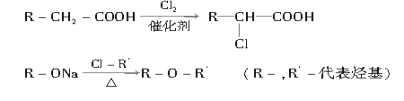
菠萝酯的合成路线如下:
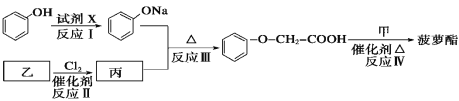
①试剂X不可选用的是(选填字母)________。
a. Na2CO3溶液 b.NaOH溶液 c.NaHCO3溶液 d.Na
②丙的结构简式是__________________,反应Ⅱ的反应类型是____________。
③反应Ⅳ的化学方程式是_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
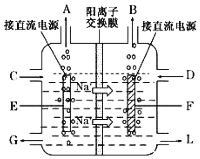
【题目】【化学—选修2:化学与技术】氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如右图所示:

(1)该流程中可以循环的物质是 。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO![]() 等无机杂质,所以在进入电解槽前需要进行两次精制,得到精制饱和食盐水。
等无机杂质,所以在进入电解槽前需要进行两次精制,得到精制饱和食盐水。
①第一次精制过程中所加除杂试剂顺序不合理的是
A.BaCl2、NaOH、Na2CO3、HCl B.BaCl2、Na2CO3、NaOH、HCl
C.NaOH、BaCl2、Na2CO3、HCl D.Na2CO3、BaCl2、NaOH、HCl
②一次精制后的食盐水仍会有少量的Ca2+、Mg2+,需要送入阳离子交换塔进行二次精制,若不经过二次精制,直接进入离子膜电解槽,这样会产生什么后果 。
(3)右图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成),则A处产生的气体是 ,F电极的名称是 。电解总反应的离子方程式为 。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为 。
(5)已知在电解槽中,每小时通过1 A的直流电理论上可以产生1.492 g的烧碱,某工厂用300个电解槽串联生产8 h,制得32%的烧碱溶液(密度为1.342 t/m3)113 m3,电解槽的电流强度1.45 ×104 A,该电解槽的电解效率为 (保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q为周期表前四周期中原子序数依次增大的元素。X原子2p能级有两个未成对电子,但没有空轨道。Y原子K层的电子数与M层的电子数的乘积等于其L层的电子数。Z与X同族。P原子的基态+2价阳离子的价电子排布为3d2。Q位于第ⅠB族。根据以上信息,回答下列问题。
(1)X的基态原子核外有 种不同运动状态的电子。
(2)Y与X可以形成多种复杂阴离子,如图所示,若其中a对应的阴离子化学式为SiO44—,则c对应的阴离子的化学式为 。
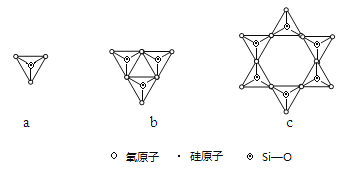
(3)Z能形成很多种含氧酸,如H2ZO3、H2ZO4。Z的某种含氧酸分子式为H2Z2O7,属于二元酸,已知其结构中所有原子都达到稳定结构,且不存在非极性键,试写出其结构式 (配位键须注明)。
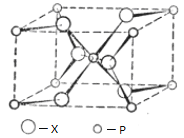
(4)P与X形成的某种晶体的晶胞结构如图所示,其晶体的化学式为 ,P的配位数为 。
(5)向盛有QZX4的溶液中加入氨水至过量,现象为 ,相关反应的离子方程式为 。NF3的空间构型是 ,NF3不易与Cu2+形成配离子,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素①~⑧在元素周期表中的位置如下,回答有关问题:

(1)画出⑥的离子结构示意图__________
(2)在①、②、④、⑤四种元素中,其离子半径按由大到小的排列顺序为 。(示例:用r(A2-)>r(B-)的形式表示)
(3)元素②、③氢化物的稳定性由强到弱的顺序为________(填化学式)。
(4)与③同一主族并且在短周期的元素的某种含氧酸可以消毒杀菌,写出该物质的电子式
(5)表中能形成两性氢氧化物的元素是_______(填元素符号),写出该元素的单质与⑧的最高价氧化物的水化物反应的离子方程式____________________________
(6)已知1mol④的单质在足量②的单质中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如表所示。下列说法中,正确的是
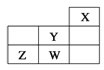
A. W的最高价氧化物对应的水化物是强酸
B. Y的原子半径在同周期主族元素中最大
C. W的非金属性比Z的弱
D. Z的气态氢化物的稳定性在同主族元素中最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列金属防腐的措施中,① 水中的钢闸门连接电源的负极使用的是 法;
② 地下钢管连接镁块使用的是 法。
(2)NO2、O2和熔融NaNO3可制作燃料电池,其原理见右图,石墨Ⅰ为电池的 极;该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,其电极反应式为 。

(3)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,右图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。回答下列问题:

① A极为电池 极,电极反应式为 。

② 若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol·L-1的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为 (标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧法是测定有机化合物化学式的一种重要方法。在一定温度下取0.1 mol某气态烃A在O2中完全燃烧,生成CO2和水蒸汽,放出热量QkJ,将生成物依次通过浓硫酸和碱石灰,浓硫酸增重7.2 g,碱石灰增重17.6 g。将烃A加入酸性KMnO4溶液或Br2的CCl4溶液,均能使它们褪色。
(1)写出烃A的分子式 ;
(2) 已知烃A分子结构高度对称且有两个甲基,请写出烃A的结构简式 ;
(3)写出烃A使Br2的CCl4溶液褪色的化学方程式 ;
(4)烃A在一定条件下可以通过加聚反应合成一种塑料,则该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学---选修3:物质结构与性质】原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时最外层电子数是其内层电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构。回答下列问题:

(1)W基态原子的价电子排布式____________;Y2X2分子中Y原子轨道的杂化类型为______。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是_____________。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是____________。Y60用做比金属及其合金更为有效的新型吸氢材料,其分子结构为球形32面体,它是由60个Y原子以20个六元环和12个五元环连接而成的具有30个Y=Y键的足球状空心对称分子。则该分子中σ键和π键的个数比_____;36gY60最多可以吸收标准状况下的氢气_____L。
(4)元素W的一种氯化物晶体的晶胞结构如右图所示,该氯化物的化学式是___________,该晶体中W的配位数为___________。它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com