
【题目】如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH﹣Ni电池),下列有关说法中不正确的是( ) 
A.放电时正极反应为:NiOOH+H2O+e﹣→Ni(OH)2+OH﹣
B.电池的电解液可为KOH溶液
C.充电时负极反应为:MH+OH﹣→H2O+M+e﹣
D.MH是一类储氢材料,其氢密度越大,电池的能量密度越高
【答案】C
【解析】解:A、放电时,正极:NiOOH+H2O+e﹣=Ni(OH)2+OH﹣ , 故A正确; B、为了防止MH被氢离子氧化,镍氢电池中电解液为碱性溶液,主要为KOH作电解液,故B正确;
C、充电时,负极作阴极,阴极反应为M+H2O+e﹣=MH+OH﹣ , 故C错误;
D、M为储氢合金,MH为吸附了氢原子的储氢合金,储氢材料,其氢密度越大,电池的能量密度越高,故D正确;
故选C.
﹣阴极反应:M+H2O+e﹣=MH+OH﹣ , 总反应:M+Ni(OH)2=MH+NiOOH;
放电时,正极:NiOOH+H2O+e﹣=Ni(OH)2+OH﹣ , 负极:MH+OH﹣﹣e﹣=M+H2O,总反应:MH+NiOOH=M+Ni(OH)2 .
以上式中M为储氢合金,MH为吸附了氢原子的储氢合金.
镍氢电池中主要为KOH作电解液充电时,阳极反应:Ni(OH)2+OH﹣=NiOOH+H2O+e-


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,将1.92g铜加入到100ml H2SO4和HNO3的混合液中,Cu全部溶解,放出无色气体,再向溶液中加入足量铁粉,充分反应,此时收集到气体为448ml(标准状况)的氢气.下列有关结论不正确的是( )
A.溶解的铁粉为2.8g
B.原溶液中c(SO42﹣)=0.5mol/L
C.原混合溶液中c(H+)=1.2mol/L
D.原溶液中n(NO3﹣)=0.08mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国药学家屠呦呦因发现植物黄花蒿叶中含有抗疟疾的物质﹣青蒿素而荣获2015年诺贝尔奖.科学家对青蒿素的结构进行进一步改良,合成药效更佳的双氢青蒿素、蒿甲醚.下列说法不正确的是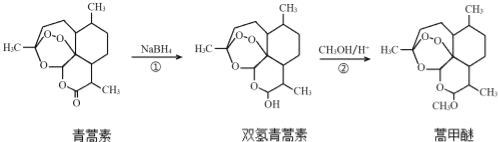
A. 利用黄花蒿叶研究青蒿素结构的基本步骤为:分离、提纯→元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式
B. 双氢青蒿素在水中的溶解性大于青蒿素
C. ①、②的反应类型分别为还原反应、取代反应
D. 青蒿素转化为双氢青蒿素,手性碳个数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NM3和D 58是正处于临床试验阶段的小分子抗癌药物,结构如下:

关于NM3和D58的叙述,错误的是
A. 都能与NaOH溶液反应,原因不完全相同
B. 都能与溴水反应,原因不完全相同
C. 都不能发生消去反应,原因相同
D. 遇FeCl3溶液都显色,原因相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的反应P(g)+Q(g)![]() R(g)+S(g)下列说法中可以充分说明这一反应已经达到化学平衡状态的是( )
R(g)+S(g)下列说法中可以充分说明这一反应已经达到化学平衡状态的是( )
A. P、Q、R、S的浓度相等
B. P 、Q、R、S在密闭容器中共存
C. P、Q、R、S的浓度不再变化
D. 用P的浓度变化表示的化学速率与用Q的浓度表示的化学反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS﹣)=1×10﹣5molL﹣1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH﹣)+c(HC2O4﹣)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大.其相关信息如下表所示:
X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
Z元素的族序数是其周期数的三倍 |
W原子的第一至第六电离能分别为:I1=578KJmol﹣1 I2=1817KJmol﹣1 I3=2745KJmol﹣1I4=11575KJmol﹣1 I5=14830KJmol﹣1 I6=18376KJmol﹣1 |
Q为前四周期中电负性最小的元素 |
元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子中未成对电子数为;X、Y、Z三种元素原子的第一电离能由小到大的顺序为(用元素符号表示).
(2)W的氯化物的熔点比Q的氯化物的熔点(填“高”或“低”),理由是
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]﹣生成,则[W(OH)4]﹣中存在(填字母) . a.极性共价键 b.非极性共价键 c.配位键 d.氢键
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如图所示.则该晶体的化学式为;晶体中每个镁原子周围距离最近的R原子有个.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2S溶液存在水解平衡:S2+H2O![]() HS+OH。下列说法正确的是( )
HS+OH。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大
B. 升高温度,c(HS)/c(S2)增大
C. 加入NaOH固体,溶液pH减小
D. 通入CuSO4固体,HS浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修2:化学与技术】
(1)火山喷发所产生的硫磺可用于生产重要的化工原料硫酸.某企业用右图所示的工艺流程生产硫酸:请回答下列问题:
①为充分利用反应放出的热量,接触室中应安装(填设备名称).吸收塔中填充有许多瓷管,其作用是 .
②为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%.为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为 . 假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 . (空气中氧气的体积分数按0.2计),该尾气的处理方法是 .
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是(可多选).
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废气减少 D.不需要使用催化剂
(2)硫酸的用途非常广泛,可应用于下列哪些方面(可多选).
A.橡胶的硫化
B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产
D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一.在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com