
【题目】常温下,将1.92g铜加入到100ml H2SO4和HNO3的混合液中,Cu全部溶解,放出无色气体,再向溶液中加入足量铁粉,充分反应,此时收集到气体为448ml(标准状况)的氢气.下列有关结论不正确的是( )
A.溶解的铁粉为2.8g
B.原溶液中c(SO42﹣)=0.5mol/L
C.原混合溶液中c(H+)=1.2mol/L
D.原溶液中n(NO3﹣)=0.08mol
【答案】D
【解析】解:常温下,将铜加入到H2SO4和HNO3的混合液中,发生反应3Cu+8H++2NO3﹣=3Cu2++2NO↑+3H2O,Cu全部溶解,放出无色气体为NO,再向溶液中加入足量铁粉,充分反应,此时收集到气体为448ml(标准状况)的氢气,说明硫酸有剩余,硝酸全部起氧化剂作用.加入的铁发生反应Fe+Cu2+=Cu+Fe2+、Fe+2H+=Fe2++H2↑,置换出溶液中的铜、与氢气.A、由离子方程式可知n(Fe)=n(Cu)+n(H2)= ![]() +
+ ![]() =0.05mol,所以加入铁粉的质量为0.05mol×56g/mol=2.8g,故A正确;
=0.05mol,所以加入铁粉的质量为0.05mol×56g/mol=2.8g,故A正确;
B、加入足量铁粉后的溶液中溶质是硫酸亚铁,根据硫酸根守恒n(H2SO4)=n(FeSO4)=0.05mol,所以原溶液中c(SO42﹣)= ![]() =0.5mol/L,故B正确;
=0.5mol/L,故B正确;
C、n(Cu)= ![]() =0.03mol,根据3Cu+8H++2NO3﹣=3Cu2++2NO↑+3H2O可知,参加反应的氢离子的物质的量为0.03mol×
=0.03mol,根据3Cu+8H++2NO3﹣=3Cu2++2NO↑+3H2O可知,参加反应的氢离子的物质的量为0.03mol× ![]() =0.08mol,n(H2)=
=0.08mol,n(H2)= ![]() =0.02mol,剩余的氢离子的物质的量为0.02mol×2=0.04mol,所以原混合溶液中c(H+)=
=0.02mol,剩余的氢离子的物质的量为0.02mol×2=0.04mol,所以原混合溶液中c(H+)= ![]() =1.2mol/L,故C正确;
=1.2mol/L,故C正确;
D、n(Cu)= ![]() =0.03mol,根据3Cu+8H++2NO3﹣=3Cu2++2NO↑+3H2O可知,原溶液中n(NO3﹣)=
=0.03mol,根据3Cu+8H++2NO3﹣=3Cu2++2NO↑+3H2O可知,原溶液中n(NO3﹣)= ![]() ×0.03mol=0.02mol,故D错误.
×0.03mol=0.02mol,故D错误.
故选:D.


科目:高中化学 来源: 题型:
【题目】某可逆反应在体积为2升的密闭容器中进行反应(A,B,C均为气体),在不同反应时间各物质的量的变化情况如图所示.则: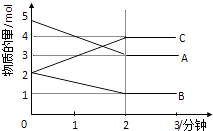
(1)该反应的化学方程为
(2)反应开始至2分钟,A的平均反应速率为
(3)反应开始至2分钟,A的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能源叙述不正确的是( )
A.大自然利用太阳能最成功的是植物的光合作用
B.H2是理想的清洁燃料,储存和运输方便,在现实生活和生产中已大量应用
C.用植物秸秆制沼气是有效利用生物质能的方式之一
D.利用工业废气中的CO2制造全降解塑料,符合绿色环保要求
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO47H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究: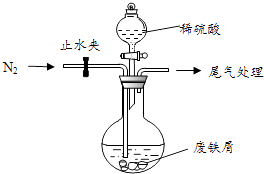
(1)【制备产品】
该小组由废铁屑(含少量氧化铜、氧化铁等杂质),用如图所示装置制备FeSO47H2O晶体,步骤如下:
①预处理:先将废铁屑加入到饱和Na2CO3溶液中洗涤,目的是 , 然后将废铁屑用水洗涤2~3遍.
②将洗涤后的废铁屑加入到圆底烧瓶中,并持续通入N2 , N2的作用是 .
③再加入足量稀硫酸,控制温度50℃~80℃之间,充分反应后,圆底烧瓶中剩余的固体为 .
④获取产品:先向步骤(3)中反应后的混合物中加入少许蒸馏水,趁热过滤, , . 滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干,密闭保存.
(2)【测定FeSO47H2O含量】
①称取上述样品10.0g,溶于适量的稀硫酸中,配成100mL溶液,需要的仪器除天平、胶头滴管、烧杯、量筒外,还需要的仪器有(填仪器名称)、 . 胶头滴管,250ml容量瓶…
②准确量取25mL该液体于锥形瓶中,用0.1000mol/L KMnO4标准溶液滴定,则滴定终点的判断方法是 .
③用同样的方法滴定3次,平均消耗10.00mL标准液,该样品中FeSO47H2O的质量分数为 . (已知Mr(FeSO47H2O)=278)
④若测量结果偏小,则可能是在定容时(填“俯视”或“仰视”)读数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铂电极电解某金属的硫酸盐(XSO4)溶液,当阳极上收集到1.12L气体(标准状况,忽略气体溶解)时,阴极质量增加6.4g,下列判断不正确的是( )
A. 电路中有0.1mol电子通过
B. 该金属是Cu
C. 电解后溶液的pH降低
D. 向电解后的溶液中加入0.1molCuO可使溶液恢复电解前的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳.核黄素分子的结构为 ,已知:
,已知:![]() ,有关核黄素的下列说法中,不正确的是
,有关核黄素的下列说法中,不正确的是
A. 该化合物的分子式为C17H22N4O6
B. 酸性条件下加热水解,有CO2生成
C. 酸性条件下加热水解,所得溶液加碱后有NH3生成
D. 能发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化铜(Ⅱ)甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:
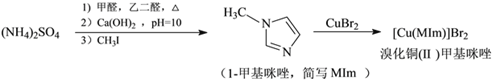
(1)铜元素位于周期表中第___族___区,基态Cu2+的核外电子排布式为______________。
(2)与NH4+互为等电子体的阴离子为__________________。
(3)MIm中碳原子杂化轨道类型为____________;1molMIm中含![]() 键数目为________ mol。
键数目为________ mol。
(4)一种铜的溴化物晶胞结构如图所示。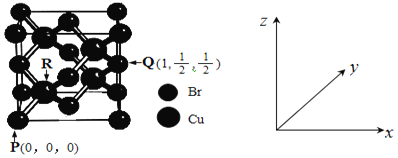
有关说法正确的是____________(填序号)。
a.该化合物的化学式为CuBr2 b.铜的配位数为8
c.与每个Br紧邻的Br有12个
d.由图中P点和Q点的原子坐标参数,可确定R点的原子坐标参数为(![]() ,
,![]() ,
,![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH﹣Ni电池),下列有关说法中不正确的是( ) 
A.放电时正极反应为:NiOOH+H2O+e﹣→Ni(OH)2+OH﹣
B.电池的电解液可为KOH溶液
C.充电时负极反应为:MH+OH﹣→H2O+M+e﹣
D.MH是一类储氢材料,其氢密度越大,电池的能量密度越高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com