
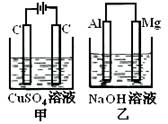
 如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当电路中通过的电子都是0.1mol时,下列说法正确的是( )
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当电路中通过的电子都是0.1mol时,下列说法正确的是( )
A.相同条件下产生气体的体积:V甲=V乙
B.溶液pH值变化:甲减小乙增大
C.溶液的质量变化:甲减小乙增大
D.电极反应式:甲中阴极:Cu2++2e—= Cu,
乙中负极:Mg - 2e—= Mg2+
【知识点】原电池和电解池原理
【答案解析】C 解析:A.甲中总反应为:2CuSO4+2H2O 2Cu+2H2SO4+O2↑,乙中总反应为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,当两装置电路中通过的电子都是0.1mol时,甲中产生0.025molO2,乙中产生0.05molH2,故相同条件下,甲乙中产生气体的体积比为1:2,故A错误;B.甲中生成H2SO4,pH减小,乙中消耗NaOH,pH减小,故B错误;C.根据电极反应式,甲溶液质量减小,乙溶液质量增大,故C正确;D.甲中阴极为Cu2+放电,电极反应为Cu2++2e-=Cu,乙中负极为Al放电,电极反应为:Al-3e-+4OH-=AlO2-+2H2O,故D错误。
2Cu+2H2SO4+O2↑,乙中总反应为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,当两装置电路中通过的电子都是0.1mol时,甲中产生0.025molO2,乙中产生0.05molH2,故相同条件下,甲乙中产生气体的体积比为1:2,故A错误;B.甲中生成H2SO4,pH减小,乙中消耗NaOH,pH减小,故B错误;C.根据电极反应式,甲溶液质量减小,乙溶液质量增大,故C正确;D.甲中阴极为Cu2+放电,电极反应为Cu2++2e-=Cu,乙中负极为Al放电,电极反应为:Al-3e-+4OH-=AlO2-+2H2O,故D错误。
故答案选C
【思路点拨】本题考查原电池和电解池的原理,题目难度中等,易错点为D,注意乙中负极
为Al放电,电极反应为:Al-3e-+4OH-=AlO2-+2H2O,总反应为2Al+2NaOH+2H2O=2NaAlO2+3H2


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
在一密闭容器中加入A、B、C三种气体,保持温度一定,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论正确的是
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol·L-1) | 6 | 3 | 2 | 2 |
| c(B)/(mol·L-1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol·L-1) | 1 | 2.5 | 3 | 3 |
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.该温度下此可逆反应平衡常数K=4
D.该反应的化学方程式为2A(g)+B(g) C(g)
C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
在反应Cu + 4HNO3(浓)=== Cu(NO3)2 + 2NO2↑ + 2H2O中:
(1)上述反应的离子方程式为 。
(2)该反应中氧化剂为_________________,氧化产物为_________________(填化学式)
(3)当该反应有32gCu被消耗,被还原的HNO3的物质的量是_____________,转移的电子的物质的量是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:下列有关说法不正确的是 ( )
①SO2+2Fe3++2H2O===SO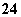 +2Fe2++4H+
+2Fe2++4H+
②Cr2O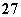 +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
A.氧化性Cr2O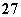 >Fe3+>SO2
>Fe3+>SO2
B.Cr2O 能将Na2SO3氧化成Na2SO4
能将Na2SO3氧化成Na2SO4
C.若33.6LSO2(标准状况)参加反应,则最终消耗K2Cr2O7 0.5mol
D.每反应1molK2Cr2O7 ,转移电子3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产、生活、社会密切相关。下列说法中不正确的是( )
A.绿色化学的核心是从源头上消除工业生产对环境的污染。
B.“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致。
C.铁在潮湿的空气中放置,易发生化学腐蚀而生锈。
D.华商科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的
二氧化硅。
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学——物质结构与性质]
近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致。钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
(1)铬元素的基态原子的价电子层排布式是 。
(2)C元素与其同主族下一周期元素组成的晶体中,C原子的杂化方式为 .
| 元 素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 |
(3)Mn和Fe的部分电离能数据如表:
根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(4)镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。
某镍配合物结构如右图所示,分子内含有的作用力
 有 (填序号)。
有 (填序号)。
A.氢键 B.离子键 C.共价键
D.金属键 E.配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是 。
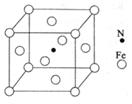 (5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。
试推测:四羰基镍的晶体类型是
(6)铁能与氮形成一种磁性材料,其晶胞结构如右图所示,
则该磁性材料的化学式为
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+2B(g)=C(g)的反应过程中能量变化如图所示.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.下列相关说法正确的是( )
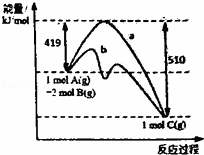
|
| A. | 该反应是吸热反应 | B. | 催化剂改变了该反应的焓变 |
|
| C. | 催化剂降低了该反应的活化能 | D. | 该反应的焓变△H=﹣510kJ.mo1﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,若 N2、H2、NH3起始浓度分别为c1、c2、c3(均不为0),当达平衡时N2、H2、NH3的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
|
| A. | c1:c2=1:3 |
|
| B. | N2、H2的转化率不相等 |
|
| C. | 平衡时,H2和NH3的生成速率之比为3:2 |
|
| D. | c1的取值范围为0<c1<0.14 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是( )
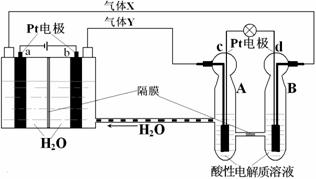 A.转移0.1mol电子时,a电极产生1.12LH2(标准状况)
A.转移0.1mol电子时,a电极产生1.12LH2(标准状况)
B.b电极上发生的电极反应是:
2H2O+2e-=H2↑+2OH-
C.c电极上进行还原反应,B电池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com