
| A. | 0.025 mol | B. | 0.050 mol | C. | 0.100 mol | D. | 0.20 mol |
分析 根据电解过程中转移电子守恒找出氯气和硫酸的关系式,根据氯气计算硫酸的消耗量,
设生成0.050摩氯气需转移的电子为xmol,
2Cl--2e-=Cl2↑
2mol 1mol
x 0.050mol
解得x=0.1mol,
设消耗硫酸的物质的量为ymol,
放电时,铅蓄电池的电池反应式为:
PbO2+Pb+2H2SO4=2PbSO4+2H2O 转移电子
2mol 2mol
y 0.1mol
y=0.1
所以消耗硫酸 0.1mol,由此分析解答.
解答 解:根据电解过程中转移电子守恒找出氯气和硫酸的关系式,根据氯气计算硫酸的消耗量,
设生成0.050摩氯气需转移的电子为xmol,
2Cl--2e-=Cl2↑
2mol 1mol
x 0.050mol
解得x=0.1mol,
设消耗硫酸的物质的量为ymol,
放电时,铅蓄电池的电池反应式为:
PbO2+Pb+2H2SO4=2PbSO4+2H2O 转移电子
2mol 2mol
y 0.1mol
y=0.1
所以消耗硫酸 0.1mol,故选C.
点评 本题以电解池为载体考查了氧化还原反应的有关计算,明确反应过程中电荷守恒是解本题的关键.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:选择题
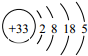 ,下列关于As的描述不正确的是( )
,下列关于As的描述不正确的是( )| A. | 位于第四周期,第ⅤA族 | B. | 属于非金属元素 | ||
| C. | 酸性:H3AsO4>H3PO4 | D. | 稳定性:AsH3<PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 0.3molFeBr2与0.4molCl2在溶液中反应:8Cl2+6Fe2++10Br-═6Fe3++16Cl-+5Br2 | |
| C. | Cu与稀HNO3反应:Cu+4H++2NO3-═Cu2++2NO↑+2H2O | |
| D. | AgCl固体溶于足量氨水:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的单质的熔点最高 | |
| B. | X元素的非金属性最强 | |
| C. | 最高价氧化物的水化物按酸性增强碱性减弱的顺序是YZWX | |
| D. | Z的原子半径最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
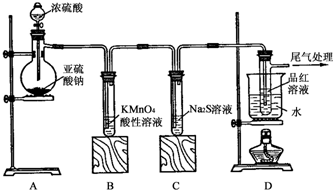
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
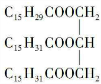 或
或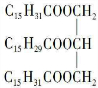 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com