
.适用相关化学知识进行判断,下列结论正确的是
A.某吸热反应能自发进行,则该反应的△S>0
B.SO2使酸性KMnO4溶液褪色,因此SO2具有漂白性
C.在物质分离的方法中,蒸馏、萃取、重结晶都与物质的溶解度有关
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能加快生成H2的速率
【知识点】物质分离的方法 化学反应的方向J2 G2 D3
【答案解析】A 解析:A、吸热、熵减的反应一定不能自发,如果吸热反应能自发进行,则该反应一定是熵增的反应,即△S>0,故A正确;B、SO2使酸性KMnO4溶液褪色是因为SO2具有还原性,SO2使品红溶液褪色,体现SO2具有漂白性,故B错误;C、在物质分离的方法中,蒸馏与物质的溶解度无关,利用的是各成分的沸点有较大差异,故C错误;D、铁遇浓硫酸发生钝化阻止了反应的进行,不能加快反应速率,故D错误。
故答案选A
【思路点拨】本题考查了物质分离的方法、化学反应的方向等,注意区别SO2使有色溶液褪色原因的不同,知道褪色并不一定是漂白作用。


科目:高中化学 来源: 题型:
化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+: Cu2+(aq)+MnS(s)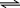 CuS(s)+Mn2+(aq),下列说法错误的是 ( )
CuS(s)+Mn2+(aq),下列说法错误的是 ( )
A.相同条件下,MnS的Ksp比CuS的Ksp大
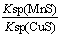 B.该反应的平衡常数K=
B.该反应的平衡常数K=
C.该反应达到平衡时c(Mn2+)=c(Cu2+)
D.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
查看答案和解析>>
科目:高中化学 来源: 题型:
10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,该溶液的pH升高的原因是HCO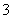 的水解程度增大,故碱性增强,该反应的离子方程式为____________________________________。乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3。
的水解程度增大,故碱性增强,该反应的离子方程式为____________________________________。乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3。
(2)丙同学认为甲、乙的判断都不充分。
丙认为:只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)的判断正确。试剂X是________。
A.Ba(OH)2溶液 B.BaCl2溶液
C.NaOH溶液 D.澄清的石灰水
(3)将加热后的溶液冷却到10 ℃,若溶液的pH________8.3(填“高于”、“低于”或“等于”),则________(填“甲”或“乙”)判断正确。
(4)查阅资料,发现NaHCO3的分解温度为150 ℃,丙断言________(填“甲”或“乙”)的判断是错误的,理由是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇: CO(g)+2H2(g) 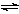 CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是
CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是
A.T1>T2
B.该反应的△H >0
C.T1时的平衡常数K1> T2时的平衡常数K2
D.T1时的平衡常数K1< T2时的平衡常数K2
查看答案和解析>>
科目:高中化学 来源: 题型:
( I) 在一个容积固定不变的密闭容器中进行反应:
2X(g) + Y(g)  2Z(g) 若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H 0; ( 填:“< ,> ,= ”)。该反应在 (填:高温或低温)条件下能自发进行。
2Z(g) 若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H 0; ( 填:“< ,> ,= ”)。该反应在 (填:高温或低温)条件下能自发进行。
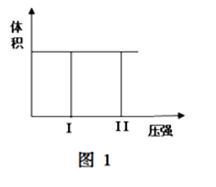
(II)在容积可变的密闭容器中发生反应:mA(g) + nB(g)  pC(g) ,
pC(g) ,
在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如
下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
⑴当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
⑵维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是 mol.
⑶当压强为1×106 Pa时,此反应的平衡常数表达式: 。
⑷其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如下图,请在图中补充画出压强分别为5×105 Pa和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。
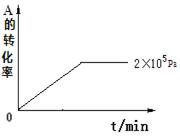
查看答案和解析>>
科目:高中化学 来源: 题型:
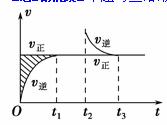
、恒温密闭容器发生可逆反应:Z(?)+W(?) X(g)+Y(?);ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后不再改变条件。下列有关说法中正确的是 ( )
X(g)+Y(?);ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后不再改变条件。下列有关说法中正确的是 ( )
A.Z和W在该条件下都不可能为气态
B.t1~t2时间段与t3时刻后,两时间段反应体系中
气体的平均摩尔质量不可能相等
C.若该反应只在某温度T0以上自发进行,则该反应
的平衡常数K随温度升高而增大
D.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生设计一水果电池:他把一铁钉和碳棒用导线连接好,然后将铁钉和碳棒平行插入一新鲜西红柿中,再在导线中接一个灵敏电流计.据此下列叙述正确的是 ( )
A.电流计指针不会发生偏转
B.金属铁会被腐蚀
C.碳棒作负极
D.铁表面有气体逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
有关常温下pH均为3的醋酸和硫酸的说法正确的是 ( )
A.两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol/L
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.醋酸中的c(CH3COO-)和硫酸中的c(SO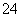 )相等
)相等
D.分别加入足量锌片,两种溶液生成H2的体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
化学平衡原理在工农业生产中发挥着重要的指导作用.
(1)反应C(s)+CO2(g)⇌2CO(g)平衡常数K的表达式为 = ;已知C(s)+H2O(g)⇌CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)⇌CO(g)+H2O(g)的平衡常数为K2,则K与K1、K2二者的关系为 .
(2)已知某温度下,反应2SO2(g)+O2 (g)⇌2SO3(g),的平衡常数K=19,在该温度下的体积固定的密闭容器中充入C(SO2)=1mol•L﹣1,C(O2)=1mol•L﹣1,当反应在该温度下SO2转化率为80%时,该反应 (填“是”或“否”)达到化学平衡状态,若未达到,向 (填“正反应”或“逆反应”) 方向进行.
(3)对于可逆反应:aA(g)+bB(g)⇌cC(g)+dD(g)△H=a kJ•mol﹣1;若a+b>c+d,增大压强平衡向 (填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a 0(填“>”或“<”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com