
【题目】某化学兴趣小组用甲装置(如下图所示)进行乙酸与乙醇酯化反应的实验,回答以下问题:
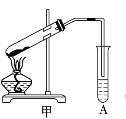
⑴乙酸和乙醇进行酯化反应的化学方程式是:______。
⑵实验过程中选用的用品及试剂有:
①碎瓷片,作用为_______;
②乙酸、乙醇以及_______,该试剂作用为___________;
③A中盛放的是_____,作用为________。
【答案】CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O 防止暴沸 浓硫酸 催化剂和吸水剂 饱和碳酸钠溶液 吸收乙酸,溶解乙醇,降低乙酸乙酯的溶解度
CH3COOC2H5+H2O 防止暴沸 浓硫酸 催化剂和吸水剂 饱和碳酸钠溶液 吸收乙酸,溶解乙醇,降低乙酸乙酯的溶解度
【解析】
(1)乙酸和乙醇发生酯化反应生成乙酸乙酯,此反应为可逆反应,条件为浓硫酸加热,据此书写反应方程式;
(2)碎瓷片可以防暴沸;酯化反应的催化剂是浓硫酸;收集酯用的是饱和碳酸钠溶液,能溶解乙醇、反应掉乙酸并降低乙酸乙酯的溶解度,据此分析解答。
(1)乙酸和乙醇发生酯化反应生成乙酸乙酯,此反应为可逆反应,条件为浓硫酸加热,反应的化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(2)①碎瓷片可以防暴沸;故答案为:防暴沸;
②制备乙酸乙酯的酯化反应除了反应物为乙酸和乙醇外,还需浓硫酸作催化剂和吸水剂,浓硫酸作催化剂可加快酯化反应的速率,作吸水剂有利于酯化反应正向进行、提高原料的利用率;故答案为:浓硫酸;催化剂和吸水剂;
③收集酯用的是饱和碳酸钠溶液,用饱和碳酸钠溶液来收集乙酸乙酯,可以溶解掉乙醇、反应掉乙酸并降低乙酸乙酯的溶解度的作用,故答案为:饱和碳酸钠溶液;溶解乙醇,吸收乙酸,降低乙酸乙酯的溶解度。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl-,降低对电解的影响,反应原理如下:Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=akJ/mol;Cl-(aq)+Cu+(aq)
2Cu+(aq) ΔH1=akJ/mol;Cl-(aq)+Cu+(aq)![]() CuCl(s) ΔH2=bkJ/mol,实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。下列说法正确的是( )
CuCl(s) ΔH2=bkJ/mol,实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。下列说法正确的是( )
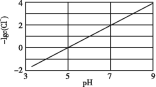
A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡后,增大c(Cu2+),c(Cl-)减小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl-(aq)
Cu2+(aq)+Cl-(aq)![]() CuCl(s)的ΔH=(a+2b)kJ/mol
CuCl(s)的ΔH=(a+2b)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体依次通过下图实验的处理,结果得到酸性溶液,几乎无气体剩余,则甲气体的组成为

A.NH3、NO2、N2B.NH3、NO、CO2
C.NH3、NO2、CO2D.NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,1L 1mol/LHF溶液中含HF分子数目为NA
B.2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g) △H=-a kJ·mol-1,将2mol CO2和6mol H2在一密闭容器中按照上述反应充分反应放出a kJ的热量
CH3CH2OH(g)+3H2O(g) △H=-a kJ·mol-1,将2mol CO2和6mol H2在一密闭容器中按照上述反应充分反应放出a kJ的热量
C.78gNa2O2固体中含阴离子数目为NA
D.25g质量分数68%的H2O2水溶液中含氧原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构白色晶体,有与石墨相似的层状结构。层内的H3BO3分子通过氢键相连(如图)。下列有关说法正确的是

A. 正硼酸晶体属于原子晶体 B. H3BO3分子的稳定性与氢键有关
C. 分子中B原子杂化轨道的类型为sp3 D. 含1mol H3BO3晶体中有3mol氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习中常用类推方法,下列类推正确的是( )
A. 离子晶体NH4Cl的所有原子的最外层均满足2个或8个电子的稳定结构,离子晶体NH4H的所有原子的最外层电子均满足2个或8个电子的稳定结构
B. 固态CO2是分子晶体,固态SiO2也是分子晶体
C. NCl3中N原子是sp3杂化,BCl3中B原子也是sp3杂化
D. 已知Be与Al的化学性质相似,Al(OH)3、Be(OH)2都能与NaOH溶液反应,且生成的盐都可用NaXO2表示(X表示Al或Be)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,不能表明反应:A(s)+2B(g)![]() C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
A.混合气体的压强B.混合气体的密度
C.B的物质的量浓度D.混合气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】J、M、Q、R、T、X、Y、Z为前四周期原子序数依次增大的8种元素(不包含0族元素)。J的原子半径是周期表所有元素中最小的,M基态原子的3个能级所含电子数相同,R的基态原子2p能级上未成对电子数与M相同,T的基态原子含13种运动状态不同的电子,X与R位于同一主族,Y的基态原子最外层有7个电子,Z的基态原子最外层电子数是次外层的1/7。(回答问题时用字母对应的元素符号)

⑴基态Z2+的核外电子排布式是______。
⑵Q、R、X的第一电离能由大到小的顺序是______。
⑶X8的结构如图甲所示,其熔沸点均高于XR2,原因是______。
⑷气态XR3以单分子形式存在,其分子的立体构型为______;固体XR3中存在如图乙所示的三聚分子,该分子中X原子的杂化轨道类型为______。
⑸不考虑配离子[T(RJ)4]-的空间构型, [T(RJ)4]-的结构式可以表示为______。(用“→”表示其中的配位键)
⑹由T、Q原子形成的晶体晶胞如图丙所示,相邻T、Q原子间以共价键相连接。该晶体的化学式为______,预测该晶体熔点高或低,并说明理由:_____。
⑺ZX2晶体的晶胞如图丁所示,距离每个Z2+最近的Z2+的个数是______。
⑻JY易溶于水的原因是______。
⑼1 mol MR(QJ2)2中所含σ键的数目是______。
⑽MQR-的中心原子的轨道杂化类型是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图W、X、Y、Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实现图示转化关系的是( )
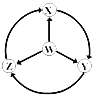 (选项中按 W X Y Z 的顺序)
(选项中按 W X Y Z 的顺序)
A. S SO2 SO3 H2SO4 B. Na Na2O2 NaOH NaCl
C. Fe FeCl3 Fe(OH)2 FeCl2 D. Al AlCl3 NaAlO2 Al2(SO4)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com