
【题目】J、M、Q、R、T、X、Y、Z为前四周期原子序数依次增大的8种元素(不包含0族元素)。J的原子半径是周期表所有元素中最小的,M基态原子的3个能级所含电子数相同,R的基态原子2p能级上未成对电子数与M相同,T的基态原子含13种运动状态不同的电子,X与R位于同一主族,Y的基态原子最外层有7个电子,Z的基态原子最外层电子数是次外层的1/7。(回答问题时用字母对应的元素符号)

⑴基态Z2+的核外电子排布式是______。
⑵Q、R、X的第一电离能由大到小的顺序是______。
⑶X8的结构如图甲所示,其熔沸点均高于XR2,原因是______。
⑷气态XR3以单分子形式存在,其分子的立体构型为______;固体XR3中存在如图乙所示的三聚分子,该分子中X原子的杂化轨道类型为______。
⑸不考虑配离子[T(RJ)4]-的空间构型, [T(RJ)4]-的结构式可以表示为______。(用“→”表示其中的配位键)
⑹由T、Q原子形成的晶体晶胞如图丙所示,相邻T、Q原子间以共价键相连接。该晶体的化学式为______,预测该晶体熔点高或低,并说明理由:_____。
⑺ZX2晶体的晶胞如图丁所示,距离每个Z2+最近的Z2+的个数是______。
⑻JY易溶于水的原因是______。
⑼1 mol MR(QJ2)2中所含σ键的数目是______。
⑽MQR-的中心原子的轨道杂化类型是______。
【答案】[Ar]3d6 N、O、S S8相对分子质量大,分子间范德华力强 平面三角形 sp3杂化 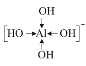 AlN 熔点高,晶体类型为原子晶体 12 HCl为极性分子,极性分子易溶于极性溶剂水中 7NA sp杂化
AlN 熔点高,晶体类型为原子晶体 12 HCl为极性分子,极性分子易溶于极性溶剂水中 7NA sp杂化
【解析】
J、M、Q、R、T、X、Y、Z为前四周期原子序数依次增大的8种元素,J的原子半径是周期表所有元素中最小的,则J为H元素;M基态原子的3个能级所含电子数相同,则M的核外电子排布式为1s22s22p2,推知M为C元素;R的基态原子2p能级上未成对电子数与M相同,为2,则R的核外电子排布式为1s22s22p4,为O元素;根据M、Q、R原子序数依次增大的信息可知,Q为N元素;T的基态原子含13种运动状态不同的电子,则T为Al元素;X与O位于同一主族,为S元素;Y的基态原子最外层有6个电子,原子序数比X大,则推知为Cl元素;Z的基态原子最外层电子数是次外层的1/7,则Z为Fe元素,结合物质的结构与性质分析作答。
根据上述分析可知,J、M、Q、R、T、X、Y、Z分别是H、C、N、O、Al、S、Cl和Fe元素,则
⑴Fe的原子序数为26,其核外电子排布式为[Ar]3d64s2,故基态Fe2+的核外电子排布式是[Ar]3d6;
⑵Q、R、X分别是N、O、S,因同一周期第一电离能呈增大趋势,但N位于第V族,p能级为半充满结构,处于稳定状态,其第一电离能比O的大,而S与O位于同一主族,S的第一电离能比O的小,故第一电离能由大到小的顺序是:N、O、S;
⑶S8和SO2均为分子晶体,但S8的相对分子质量较大,分子间范德华力强,因此熔沸点较SO2高,故答案为:S8相对分子质量大,分子间范德华力强;
⑷气态SO3以单分子形式存在,其价层电子对数=3+![]() =3,故其分子的立体构型为平面三角形;根据图中X的成键方式空间构型为四面体可知,X原子的杂化轨道类型为sp3杂化,故答案为:平面三角形;sp3杂化;
=3,故其分子的立体构型为平面三角形;根据图中X的成键方式空间构型为四面体可知,X原子的杂化轨道类型为sp3杂化,故答案为:平面三角形;sp3杂化;
⑸[Al(OH)4]-中Al3+为中心离子,OH-为配体,O原子提供孤对电子,配位数为4,则其构型可表示为: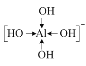 ;
;
⑹根据均摊法可知,晶胞内Al的个数为:![]() =4,N的个数为:4,故该晶体的化学式为AlN;根据题意可知,该晶体为原子晶体,因此熔点较高,故答案为:AlN;熔点高,晶体类型为原子晶体;
=4,N的个数为:4,故该晶体的化学式为AlN;根据题意可知,该晶体为原子晶体,因此熔点较高,故答案为:AlN;熔点高,晶体类型为原子晶体;
⑺根据图中立体结构可知,距离每个Fe2+最近的Fe2+的个数是12,故答案为:12;
⑻HCl为极性分子,水也为极性分子,根据相似相溶原理可知,极性分子易溶于极性溶剂水中,故答案为:HCl为极性分子,极性分子易溶于极性溶剂水中;
⑼CO(NH2)2的结构简式为:NH2-CO-NH2,其中1mol所含σ键的数目是7NA,故答案为:7NA;
⑽CNO-的中心原子C的的价层电子对数=2+![]() =2,其杂化轨道类型为sp杂化。
=2,其杂化轨道类型为sp杂化。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】柠檬烯是一种食用香料,其结构简式如图所示。下列有关柠檬烯的分析正确的是( )
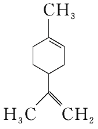
A. 它的一氯代物有6种
B. 它的分子中所有的碳原子一定在同一平面上
C. 它和丁基苯![]() 互为同分异构体
互为同分异构体
D. 一定条件下,它分别可以发生加成、取代、氧化、还原等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用甲装置(如下图所示)进行乙酸与乙醇酯化反应的实验,回答以下问题:
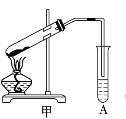
⑴乙酸和乙醇进行酯化反应的化学方程式是:______。
⑵实验过程中选用的用品及试剂有:
①碎瓷片,作用为_______;
②乙酸、乙醇以及_______,该试剂作用为___________;
③A中盛放的是_____,作用为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.反应2CO(g)+O2(g)=2CO2(g)在一定条件下能自发进行的原因是ΔS>0
B.由Ksp[Mg(OH)2]=1.8×10-11可知常温下pH=8的溶液中,c(Mg2+)≤1.8×10-5mol·L1
C.反应H2(g)+Cl2(g)=2HCl(g)的ΔH可用下式换算:ΔH=反应中断裂的旧化学键键能之和-反应中形成的新化学键键能之和
D.由反应C(s)+1/2O2 (g)=CO(g)ΔH=-111 kJ·mol1可知C的燃烧热是111 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种主族元素X、Y、Z、M和N在周期表中的位置如图所示。下列说法正确的是

A. M的原子半径比N小
B. Y和Z既可形成Z2Y,也可形成Z2Y2
C. X2M的热稳定性比X2Y强
D. M和N的氧化物的水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解,其中:6XeF4+12H2O==2XeO3+4Xe↑ +24HF+3O2↑。下列推测正确的是( )
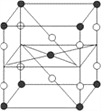
A. XeF2分子中各原子均达到八电子结构
B. 某种氟化氙的晶体结构单元如图,可推知其化学式为XeF6
C. XeF4按已知方式水解,每生成4molXe,转移16mol电子
D. XeF2加入水中,在水分子作用下将重新生成Xe和F2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:
(1)X与L组成的最简单化合物的电子式为_____。
(2)X与M组成的物质为_______(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为______。
(3)Y的含氧酸的化学式为_____。其酸性来源不是本身电离出质子,而是能结合水分子电离的氢氧根离子,释放出质子,所以该酸为___元酸。
(4)L基态原子电子的最高能层符号为____,L的最高价含氧酸根离子的等电子体有__、__(写出一个分子和一个离子)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol![]()
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g)![]() 2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
A. v(A)=0.15mol/(L·min) B. v (B)=0.6 mol/(L·min)
C. v (C)=0.3 mol/(L·min) D. v (D)=0.1 mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com