
【题目】X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:
(1)X与L组成的最简单化合物的电子式为_____。
(2)X与M组成的物质为_______(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为______。
(3)Y的含氧酸的化学式为_____。其酸性来源不是本身电离出质子,而是能结合水分子电离的氢氧根离子,释放出质子,所以该酸为___元酸。
(4)L基态原子电子的最高能层符号为____,L的最高价含氧酸根离子的等电子体有__、__(写出一个分子和一个离子)。
【答案】 离子 CaH2+2H2O=Ca(OH)2+2H2↑ H3BO3 一 M SiF4 ClO4-
离子 CaH2+2H2O=Ca(OH)2+2H2↑ H3BO3 一 M SiF4 ClO4-
【解析】
X2是最轻的气体,X应为H元素,Y、L与M三种元素的质子数均为5的倍数,且为主族元素,则质子数分别为5、15、20,分别B、P、Ca等元素,结合对应单质、化合物的性质以及元素周期率解答该题。
(1)X与L组成的最简单化合物PH3,电子式类似氨气,为 ;
;
答案:
(2)X与M组成的物质为CaH2,为离子化合物,可与水反应生成氢气,方程式为CaH2+2H2O=Ca(OH)2+2H2↑ ;
答案:离子 CaH2+2H2O=Ca(OH)2+2H2↑
(3)Y为B元素,位于周期表第二周期ⅢA族,含氧酸为H3BO3,其酸性来源不是本身电离出质子,而是能结合水分子电离的氢氧根离子,释放出质子,电离方程式B(OH)3+H20![]() [B(OH)4]- + H+,所以该酸为一元酸;
[B(OH)4]- + H+,所以该酸为一元酸;
答案:H3BO3 一
(4)L为P,基态原子结构示意图为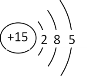 ,,因此最高能层符号为M,L的最高价含氧酸根离子为PO43-,含有50个电子,等电子体有SiF4 、ClO4-;
,,因此最高能层符号为M,L的最高价含氧酸根离子为PO43-,含有50个电子,等电子体有SiF4 、ClO4-;
答案:SiF4 ClO4-


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体依次通过下图实验的处理,结果得到酸性溶液,几乎无气体剩余,则甲气体的组成为

A.NH3、NO2、N2B.NH3、NO、CO2
C.NH3、NO2、CO2D.NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,不能表明反应:A(s)+2B(g)![]() C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
A.混合气体的压强B.混合气体的密度
C.B的物质的量浓度D.混合气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】J、M、Q、R、T、X、Y、Z为前四周期原子序数依次增大的8种元素(不包含0族元素)。J的原子半径是周期表所有元素中最小的,M基态原子的3个能级所含电子数相同,R的基态原子2p能级上未成对电子数与M相同,T的基态原子含13种运动状态不同的电子,X与R位于同一主族,Y的基态原子最外层有7个电子,Z的基态原子最外层电子数是次外层的1/7。(回答问题时用字母对应的元素符号)

⑴基态Z2+的核外电子排布式是______。
⑵Q、R、X的第一电离能由大到小的顺序是______。
⑶X8的结构如图甲所示,其熔沸点均高于XR2,原因是______。
⑷气态XR3以单分子形式存在,其分子的立体构型为______;固体XR3中存在如图乙所示的三聚分子,该分子中X原子的杂化轨道类型为______。
⑸不考虑配离子[T(RJ)4]-的空间构型, [T(RJ)4]-的结构式可以表示为______。(用“→”表示其中的配位键)
⑹由T、Q原子形成的晶体晶胞如图丙所示,相邻T、Q原子间以共价键相连接。该晶体的化学式为______,预测该晶体熔点高或低,并说明理由:_____。
⑺ZX2晶体的晶胞如图丁所示,距离每个Z2+最近的Z2+的个数是______。
⑻JY易溶于水的原因是______。
⑼1 mol MR(QJ2)2中所含σ键的数目是______。
⑽MQR-的中心原子的轨道杂化类型是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图装置的叙述正确的是

A.电子由Pt流向Fe
B.这是电解NaOH溶液的装置
C.该装置中Fe为阴极,电极反应为:Fe-2e-+2OH-=Fe(OH)2
D.该装置中Pt为正极,电极反应为:O2 + 2H2O + 4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:2NO(g) + O2(g)![]() 2NO2(g) △H<0达平衡后,若分别采取下列措施;①增大压强 ② 减小NO2的浓度 ③增大O2浓度、④升高温度 ⑤加入催化剂,能使平衡向正向移动的是
2NO2(g) △H<0达平衡后,若分别采取下列措施;①增大压强 ② 减小NO2的浓度 ③增大O2浓度、④升高温度 ⑤加入催化剂,能使平衡向正向移动的是
A.①②③B.②③④C.③④⑤D.①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe2+的价电子排布式为_______。
(2)氮气、氨气、肼(N2H4)中氮原子孤电子对数之比为_______,氨分子的空间构型是______
(3)丙酮(![]() )分子中碳原子轨道的杂化类型是_____,1 mol 丙酮分子中含有σ键的数目为______。
)分子中碳原子轨道的杂化类型是_____,1 mol 丙酮分子中含有σ键的数目为______。
(4)C、N、O三种元素的电负性由小到大的顺序为______。
(5)乙醇的沸点高于丙酮,这是因为_____。
(6)CN-与N2是等电子体,CN-的电子式为______。
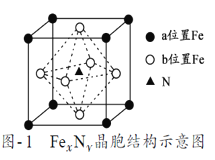
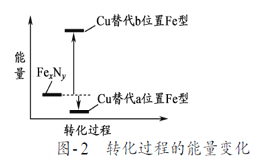
(7)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(xn)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为___,若晶胞参数为a pm,则该晶胞的密度为____g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图W、X、Y、Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实现图示转化关系的是( )
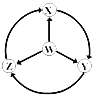 (选项中按 W X Y Z 的顺序)
(选项中按 W X Y Z 的顺序)
A. S SO2 SO3 H2SO4 B. Na Na2O2 NaOH NaCl
C. Fe FeCl3 Fe(OH)2 FeCl2 D. Al AlCl3 NaAlO2 Al2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为_____________。
(2)Na的原子结构示意图为______,Na在氧气中完全燃烧所得产物的电子式为_______。
(3)MgCl2在工业上应用广泛,可由MgO制备。
①MgO的熔点比BaO的熔点________(填“高”或“低”)
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为______;SiO2的晶体类型为________。
③MgO与炭粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐为______(写化学式)。
(4)月壤中含有丰富的3He,从月壤中提炼1 kg3He同时可得6000kgH2和700kgN2,若以所得H2和N2为原料经一系列反应最多可制得碳酸氢铵___kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com