
| A、A、已知2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol,则氢气的燃烧热为285.8 kJ/mol |
| B、B、已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 |
| C、含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.4 kJ/mol |
| D、D、已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2;则△H1>△H2 |


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
| A、①②④ | B、①②⑤ |
| C、①②③④⑤ | D、①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、这个反应是氧化还原反应 |
| B、制造过程中元素种类没有改变 |
| C、另一种化合物为NaCl |
| D、金刚石属于金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3-CH=CH2和CH2=CH2的最简式相同 |
| B、CH≡CH和C6H6含碳量相同 |
| C、正戊烷、异戊烷、新戊烷的沸点依次降低 |
| D、乙二醇和丙三醇为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在1L水中溶解10.1g KNO3,即可配制得0.1mol/L KNO3溶液 |
| B、100mL该溶液中含NO3-0.1mol |
| C、从1L该溶液中取出100mL,所取出的KNO3溶液的浓度为0.01mol/L |
| D、1L该溶液中含KNO310.1g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.18mol/L |
| B、0.24mol/L |
| C、2.0mol/L |
| D、1.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
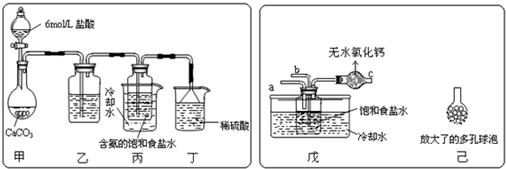
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com