
【题目】如图是某元素的价类二维图。其中X是一种强碱,G为正盐,通常条件下Z是无色液体,D的相对原子质量比C小16,各物质转化关系如图所示。下列说法正确的是
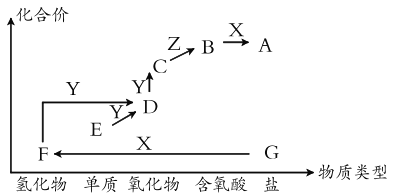
A.E 可以是金属也可以是非金属
B.C 和 D 两种大气污染物,都能用排空气法收集
C.B 的浓溶液具有吸水性,可用来干燥气体
D.实验室制备 F 时,可以将其浓溶液滴入碱石灰中进行制取
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室制取乙酸乙酯的主要步骤如下:
①配制2mL浓硫酸、3mL乙醇(含18O)和2mL乙酸的混合溶液。
②按如图连接好装置并加入混合液,用小火均匀加热3~5min。
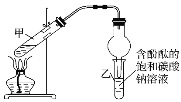
③待试管乙收集到一定量产物后停止加热,撤出试管乙用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥。
回答问题:
(1)配制混合液的操作顺序是___。
(2)装置中球形干燥管,除起冷凝作用外,另一重要作用是___。
(3)步骤②安装好实验装置,加入药品前还应检查___。
(4)写出实验中加热试管的目的:①___;②___。
(5)反应中浓硫酸的作用是__;写出能表示18O位置的制取乙酸乙酯的化学方程式:___。
(6)上述实验中饱和碳酸钠溶液的作用是__。(填字母)
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
(7)步骤③所观察到的现象是___,从试管乙中分离出乙酸乙酯的实验操作名称是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019 年是元素周期表诞生 150 周年,目前周期表七个周期均已排满,其 118 种元素。短周期元素 W、X、Y、Z在周期表中的相对位置如图所示,且 W 元素的简单氢化物的空间结构是三角锥形,下列说法不正确的是
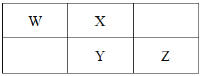
A.红葡萄酒含有 YX2,起杀菌、澄清、抗氧化的作用
B.在元素周期表中,117 号元素与 Z 元素位于同一主族
C.简单离子的半径大小顺序为:X < W < Z < Y
D.W 的氢化物与 Z 的氢化物反应,产物为共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品。某研究小组制备硫代硫酸钠晶体(Na2S2O3·5H2O)的实验装置如图所示(省略夹持装置):
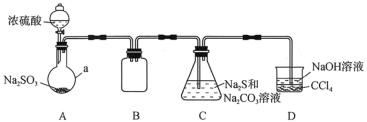
(查阅资料)
Ⅰ.Na2S2O3·5H2O是无色晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;
Ⅱ.向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3。
根据题意,填写下列空白。
(1)仪器a的名称是___;B的作用是___。
(2)C中反应氧化剂与还原剂的物质的量之比为___。
(3)该实验制取的产品中常含有少量Na2SO3和Na2SO4杂质。为了检验产品中是否含有这两种杂质,某小组设计了以下实验方案(所需试剂从稀硝酸、稀硫酸、稀盐酸、蒸馏水中选择),请将方案补充完整。
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤、洗涤后,向沉淀中滴加足量的___(填试剂名称),若___(填实验现象),则可以确定产品中含有Na2SO3和Na2SO4。
(4)称取样品137.5g配成500mL溶液。取50mL溶液,向其中加入足量稀硫酸,充分反应(S2O![]() +2H+=S↓+SO2↑+H2O),静置、过滤、洗涤、干燥、称量得沉淀1.6g。
+2H+=S↓+SO2↑+H2O),静置、过滤、洗涤、干燥、称量得沉淀1.6g。
准确配制500mL溶液所需仪器有:天平、药匙、烧杯、玻璃棒、___、___。经计算,样品中硫代硫酸晶体的百分含量为___。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用碱性氢氧燃料电池为电源进行电解的实验装置示意图如下所示。下列说法中正确的是
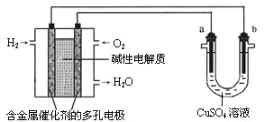
A. 燃料电池工作时,负极反应为:H2—2e-= 2H+
B. 若要实现铁上镀铜,则a极是铁,b极是铜
C. 若要实现电解精炼粗铜,则a极发生氧化反应, b极质量增加
D. 当a、b均是石墨时,当消耗H2 22.4L(标况)时,a极析出铜64g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用固体KOH配制0.1 mol/L的KOH溶液 480 mL,回答下列问题:
(1)配制过程中需要用到的玻璃仪器有______。
(2)需要用托盘天平称量______g KOH固体。
(3)如果在定容时仰视操作,则所配得溶液的浓度______0.1 mol/L(填>,=,<)。
(4)若所用的固体KOH中混有NaOH,则所配得溶液的c(OH-)浓度______0.1 mol/L (填>,=,<)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值.下列说法正确的是
A.0.1 mol 的11B中,含有0.6NA个中子
B.pH=1的H3PO4溶液中,含有0.1NA个H+
C.2.24L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分子
D.密闭容器中2 mol SO2与1 molO2反应制得2 molSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中的四种元素的有关信息如下,请用合理的化学用语填写空白。
在周期表中的区域 | 元素代号 | 有关信息 |
短周期元素 | X | X的最高价氧化物的水化物甲是一种胃酸中和剂,且能溶于强碱溶液 |
Y | Y的一种氢化物可用于制造纯碱和做制冷剂 | |
长周期元素 | Z | Z的一种盐乙可以作净水剂,Z的某种氧化物丙可以做红色涂料 |
W | W元素大多存在于海藻种,它的银盐可用于人工降雨 |
(1)X元素周期表中的位置为___,X、Y、Z三种元素的简单离子半径从大到小的顺序为___。
(2)足量W的最高价氧化物的水化物是稀溶液与1mol甲完全反应,放出热量QkJ,请写出表示该过程中和热的热化学方程式:____。
(3)下列有关W的气态氢化物丁的说法正确的有___(选填字母)
a.丁比氯化氢沸点高 b.丁比氯化氢稳定性好
c.丁比氟化氢还原性弱 d.丁比氟化氢酸性弱
(4)请写出丙溶于丁的水溶液的离子方程式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com