
����Ŀ��MnO2��һ����Ҫ�Ļ���ԭ�ϣ���ҵ���ô�MnO2�����н϶��MnO��MnCO3����Ʒת��Ϊ�ϴ���MnO2��������ͼ��ʾ��

��1���ڢٲ���Ӧ�е������ܷ���Ũ������棿____(��ܡ���)��������______________��
��2���ڢڲ������У�������ǿ��˳��ClO3��___MnO2(���������)��д���������з���Ӧ�����ӷ���ʽ��____������Ӧ��ת��2mol����ʱ�����ɵ�������������ʵ���Ϊ___mol��
��3����ҵ����MnO2Ϊԭ����ȡKMnO4����һ����MnO2��KOH���飬���ȣ��ڿ����м������ۻ������������裬��ȡK2MnO4���ڶ�����K2MnO4Ũ��Һ�ö��Ե缫���е�⣬�������ϵõ�KMnO4���������ϵõ�KOH����ȡK2MnO4�Ļ�ѧ��Ӧ����ʽΪ______����ҵ�ϲ��Ͻ����Ŀ����______��
��4���������̺������õ������ⶨ����ԭ��Ϊ����������У����������ܶ����ؽ������������ɵ⣬�Ե���Ϊָʾ����0.1000mol/L��������Ʊ���Һ�ζ����ȷ���������̺�����
MnO2+4HCl+2KI![]() MnCl2+I2+2KCl+2H2O
MnCl2+I2+2KCl+2H2O
I2+2Na2S2O3![]() 2NaI+Na2S4O6
2NaI+Na2S4O6
ȡ��Ϊ�����Ķ���������Ʒa g���뵽�����������KI��Һ�У���Ӧ�����Na2S2O3�ζ���Ӧ�����Һ������VmLNa2S2O3��Һ�������Ʒ��MnO2����Ϊ______%�����ʲ����뷴Ӧ����
���𰸡� �� Ũ�����ܱ�MnO2��������Cl2 �� 5Mn2++2 ClO3��+4H2O![]() 5MnO2+Cl2��+8H+ 1 2MnO2+4KOH+O2
5MnO2+Cl2��+8H+ 1 2MnO2+4KOH+O2![]() 2 K2 MnO4+2H2O ʹ��Ӧ����O2��ֽӴ�����߶������̵�ת���� 0.435V/a
2 K2 MnO4+2H2O ʹ��Ӧ����O2��ֽӴ�����߶������̵�ת���� 0.435V/a
�����������������̿�֪����Ʒ��ϡ�����ڼ��ȵ������½�ȡ�����˵õ��������̺���������Һ����Һ�м�����������Һ������������Ϊ�������̡�
��1���ڢٲ���Ӧ�е��������Ũ������棬��ΪŨ�����ܱ�MnO2��������Cl2��
��2���ڢڲ������У�������ǿ��˳��ClO3����MnO2���������з���Ӧ�����ӷ���ʽΪ5Mn2++2 ClO3��+4H2O![]() 5MnO2��+Cl2��+8H+���÷�Ӧ�е���ת�Ƶ���ĿΪ10e-�����Ե���Ӧ��ת��2mol����ʱ�����ɵ�������������ʵ���Ϊ1mol��
5MnO2��+Cl2��+8H+���÷�Ӧ�е���ת�Ƶ���ĿΪ10e-�����Ե���Ӧ��ת��2mol����ʱ�����ɵ�������������ʵ���Ϊ1mol��
��3����ҵ����MnO2Ϊԭ����ȡKMnO4����һ����MnO2��KOH���飬���ȣ��ڿ����м������ۻ������������裬��ȡK2MnO4���ڶ�����K2MnO4Ũ��Һ�ö��Ե缫���е�⣬�������ϵõ�KMnO4���������ϵõ�KOH����ȡK2MnO4�Ļ�ѧ��Ӧ����ʽΪ2MnO2+4KOH+O2![]() 2 K2 MnO4+2H2O����ҵ�ϲ��Ͻ����Ŀ����ʹ��Ӧ����O2��ֽӴ�����߶������̵�ת������
2 K2 MnO4+2H2O����ҵ�ϲ��Ͻ����Ŀ����ʹ��Ӧ����O2��ֽӴ�����߶������̵�ת������
��4���������̺������õ������ⶨ����ԭ��Ϊ����������У����������ܶ����ؽ������������ɵ⣬�Ե���Ϊָʾ����0.1000mol/L��������Ʊ���Һ�ζ����ȷ���������̺�����
MnO2+4HCl+2KI![]() MnCl2+I2+2KCl+2H2O
MnCl2+I2+2KCl+2H2O
I2+2Na2S2O3![]() 2NaI+Na2S4O6
2NaI+Na2S4O6
ȡ��Ϊ�����Ķ���������Ʒa g���뵽�����������KI��Һ�У���Ӧ�����Na2S2O3�ζ���Ӧ�����Һ������VmLNa2S2O3��Һ��������������ѧ����ʽ��֪��n(MnO2)=n(I2)=0.5n(Na2S2O3)=0.5![]() �������Ʒ��MnO2����Ϊ
�������Ʒ��MnO2����Ϊ![]() 0.435V/a %��
0.435V/a %��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС���������ͼ��ʾ�ĵ绯ѧװ�ã�����˵������ȷ����

A. �ҳع���ʱ��CO32-��������
B. �ҳظ�����ӦΪCH30H-6e-+3CO32-=4CO2��2H2O
C. �׳���Fe�缫�����ķ�ӦΪ2Cl- -2e-=Cl2
D. Ϊ��ʹ��س������磬����ʱ������CO2����ѭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͭ�Ƚ������仯�������ճ�������Ӧ�ù㷺����ش��������⡣
��1�������к���һ����̼������X(Fe3C)��X�������Ŀ����и������գ������д��ԵĹ���Y����Y���ڹ������ᣬ���ӷ���ʽΪ_______________________________________________________��Y�����Ũ���ᷴӦ����Һ�к��е��εĻ�ѧʽΪ____________��
��2��ij��Һ�к���Mg2����Fe2����Al3����Cu2�������ӣ������м��������NaOH��Һ���ˣ��������������ղ������պ�Ĺ���Ͷ�뵽������ϡ�����У�������Һ��ԭ��Һ��ȣ���Һ�д������ٵ���������___________(����)��
A��Mg2�� B��Fe2�� C��Al3�� D��Cu2��
��3������������Ҫ�Ĺ�ҵ���ϣ��÷���м�Ʊ������������£�

��Na2CO3��Һ���Գ����ۣ�ԭ����(�����ӷ���ʽ��ʾ)________________________________��
�ڲ������г�����ϴ�ӷ�����___________________________________________________________
����д������FeCO3���������ӷ���ʽ_______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǿ���С���ͬѧ��Ƶ�4����Ȫʵ�鷽���������йز���������������Ȫ�������
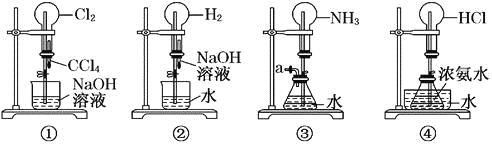
A. ��ѹװ�����Ľ�ͷ�ι�ʹCCl4ȫ��������ƿ��Ƭ�̺��ֹˮ��
B. ��ѹװ�����Ľ�ͷ�ι�ʹNaOH��Һȫ��������ƿ��Ƭ�̺��ֹˮ��
C. �ù���װ�ô�װ������a�����Ϲ����������ֹˮ��
D. ��װ������ˮ����������������Ũ���Ტ��ֹˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���NO2��O2�Ļ������12 mLͨ������ˮ�У���ַ�Ӧ��ʣ��2 mL����(ͬ��ͬѹ��)����ԭ������������������Ϊ(����)
��1.2 mL�� ��2.4 mL�� ��3 mL�� ��4 mL
A. �٢�B. �ڢ�C. �ۢ�D. �٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г�������ȷ�����������ϵ����(����)
ѡ�� | ������ | ������ |
A | Fe3���������� | FeCl3��Һ�����ڻ��շϾɵ�·���е�ͭ |
B | SiO2�е����� | SiO2�������Ʊ����ά |
C | SO2��Ư���� | SO2��ʹ��ˮ��ɫ |
D | Ũ������ǿ������ | Ũ��������ڸ���H2��CO |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Na2S2O35H2O�ڻ�ѧ���������г����������ʣ�ʵ�����Ʊ�ԭ��ΪNa2S + Na2CO3 + 4SO2 ![]() 3Na2S2O3 + CO2�����������װ�ã��г�����ʡ�ԣ�����ʵ�顣
3Na2S2O3 + CO2�����������װ�ã��г�����ʡ�ԣ�����ʵ�顣

��1��A�з�����Ӧ�Ļ�ѧ����ʽΪ_______________________________��
��2��C����ʢ�Լ�������_______________����ҪֹͣA�еĻ�ѧ��Ӧ����ȡ�¾ƾ��Ƽ����⣬�����Բ�ȡ�IJ�����__________________________��
��3����ͬѧ�ڼ���A����Һ���µ�ͭ˿��ڡ���ͬѧ�Ժ�ɫ������������¼��裺
�� ������CuO�� �� ������Cu2O�� �� ������CuS
��ͬѧ��Ϊ�����һ����������������__________����ͬѧ�������ʵ���һ����֤��ɫ���ʵ���ɣ�
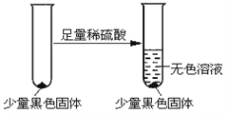
�������������������ɫ���ʵ����Ϊ________���ѧʽ����
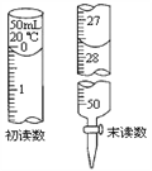
��4��ʵ������Na2S2O3����Һ�ⶨ��ˮ��Ba2+ ��Ũ�ȣ��������£�����֪��2S2O32-+I2==S4O62-+2I-����
![]()
�� д��BaCrO4���������HI��HCl��Һ��Ӧ�����ӷ���ʽ��________��
�� ���Ե���Ϊָʾ������ﵽ�ζ��յ�ʱ��������__________________��
�� ��Na2S2O3����Һ��Ũ��Ϊ0.0030 molL-1�����ĸ�Na2S2O3����Һ�������ͼ��ʾ�����ˮ��Ba2+ ��Ũ��Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ƚϸֺ�������̼������������ǰ������ߺ�̼���Ĺ�ϵ��
A.����B.����C.С��D.���ڻ�С��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com