
【题目】如图是课外活动小组的同学设计的4个喷泉实验方案.下列有关操作不可能引发喷泉现象的是
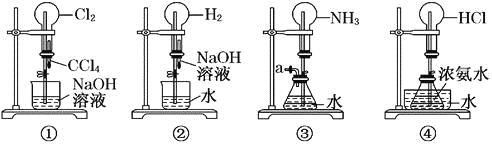
A. 挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
B. 挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
C. 用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D. 向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】以苯甲醛为原料,通过Cannizzaro反应来制备苯甲醇和苯甲酸,反应式为:
主反应:

副反应:
![]()
主要物料的物理常数如下表:
名称 | 分子量 | 性状 | 相对密度 (g·cm-3) | 沸点 (℃) | 溶解度 | ||
水 | 乙醚 | ||||||
苯甲醛 | 106 | 无色液体 | 1.04 | 179 | 微溶 | 易溶 | |
苯甲酸 | 122 | 无色晶体 | 1.27 | 249 | 0.21g | 66g | |
苯甲醇 | 108 | 无色液体 | 1.04 | 205 | 微溶 | 易溶 | |
乙醚 | 74 | 无色液体。 | 0.71 | 35 | 不溶 | -- | |
实验步骤:

(1)仪器A的作用是_______________。
(2)蒸馏操作时温度应该控制在___________左右。获得产品乙时进行的操作Ⅱ的名称是__________________。
(3)①上层溶液1中除乙醚外主要有机杂质是____________、_____________。
洗涤时先后用到了饱和NaHSO3 溶液、10%的NaHCO3溶液和水。
②洗涤操作在______________中进行。
a.烧杯 b.布氏漏斗 c.烧瓶 d.分液漏斗
③加入10%的NaHCO3溶液至___________________(填现象)时说明杂质已被除尽。
(4)若产品甲的质量为5.40 g,则产品甲的产率是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列短周期元素性质的数据判断,下列说法正确的是( )
|
|
|
|
|
|
|
| |
原子半径 |
|
|
|
|
|
|
|
|
最高价或最低价 |
|
|
|
|
|
|
|
|
A. 元素④⑤形成的化合物是离子化合物
B. 元素⑦位于第二周期第V族
C. 元素①⑧形成的化合物具有两性
D. 元素③的最高价氧化物对应水化物的碱性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是
① ②
②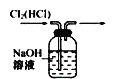
③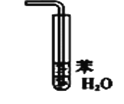 ④
④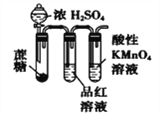
A. 用图①所示装置分离Na2CO3溶液和CH3COOC2H5的混合物
B. 装置②可用于除去Cl2中的HCl
C. 装置③可用于氯化氢气体溶于水
D. 装置④:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅直至褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的原子核外M电子层上有3个电子,元素Y的离子Y2核外有18个电子,则这两种元素可形成的化合物为( )
A.XY2B.X2Y3C.X3Y2D.X2Y2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeS 与一定浓度的HNO3 反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO 和H2O,当NO2、N2O4、NO 的物质的量之比为1:1:2 时,实际参加反应的FeS 与被还原的HNO3的物质的量之比为 ( )
A. 1:4 B. 1:5 C. 1:6 D. 1:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的化工原料,工业上用粗MnO2(含有较多的MnO和MnCO3)样品转化为较纯净MnO2的流程如图所示:

(1)第①步反应中的硫酸能否用浓盐酸代替?____(填“能”或“否”),理由是______________。
(2)第②步操作中,氧化性强弱顺序:ClO3—___MnO2(填“>”或“<”),写出操作②中发反应的离子方程式:____;当反应中转移2mol电子时,生成的氧化产物的物质的量为___mol。
(3)工业上用MnO2为原料制取KMnO4,第一步将MnO2和KOH粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH。制取K2MnO4的化学反应方程式为______,工业上不断搅拌的目的是______。
(4)二氧化锰含量可用碘量法测定,其原理为在盐酸介质中,二氧化锰能定量地将碘离子氧化成碘,以淀粉为指示剂用0.1000mol/L硫代硫酸钠标准溶液滴定碘而确定二氧化锰含量:
MnO2+4HCl+2KI![]() MnCl2+I2+2KCl+2H2O
MnCl2+I2+2KCl+2H2O
I2+2Na2S2O3![]() 2NaI+Na2S4O6
2NaI+Na2S4O6
取较为纯净的二氧化锰样品a g加入到适量的盐酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗VmLNa2S2O3溶液,则该样品中MnO2含量为______%(杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2气体分别通入下列四种溶液中,有关现象及结论的说法正确的是
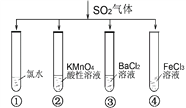
A. 试管①中有淡黄色沉淀生成,说明SO2有氧化性
B. 试管②中溶液褪色,说明SO2有漂白性
C. 试管③中能产生白色沉淀,说明SO2有酸性
D. 试管④中溶液颜色变浅,说明SO2有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.用灼热的氧化铜除去CO2中混有的少量CO
B.用NaOH溶液除去SO2中混有的HCl
C.用100mL量筒量取8.53mL蒸馏水
D.为加快过滤速度,可用玻璃棒在漏斗中搅拌
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com