
【题目】将SO2气体分别通入下列四种溶液中,有关现象及结论的说法正确的是
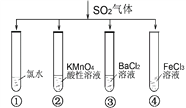
A. 试管①中有淡黄色沉淀生成,说明SO2有氧化性
B. 试管②中溶液褪色,说明SO2有漂白性
C. 试管③中能产生白色沉淀,说明SO2有酸性
D. 试管④中溶液颜色变浅,说明SO2有还原性
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】硫酸亚铁是人体常用的补铁剂,缺少Fe2+会导致缺铁性贫血。绿矾(FeSO4·7H2O)在不同温度下易分解得各种铁的氧化物和硫的氧化物。已知SO3是一种无色晶体,熔点16.8℃,沸点44.8℃,氧化性及脱水性较浓硫酸强,能漂白某些有机染料,如品红等。回答下列问题:

(1)第一组同学按照上图装置做绿矾的分解实验,并检验其分解产物。装置B中观察到品红褪色,第一组同学得出结论:绿矾的分解产物中含有______________________。
(2)第二组同学为了进一步探究褪色的原因,对第一组同学做完实验B装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中________。(填字母)
A.不含SO2 B.一定含有SO3 C.可能含SO2
(3)第三组同学查阅资料发现绿矾受热分解还可能有O2放出,为此,第三组同学从下图中选取了部分仪器设计了一套检验绿矾分解的气体产物装置:

①第三组同学的实验装置中,依次连接的合理顺序为a→___→ → → → 。
②验证分解产物中有O2的简要实验操作步骤及现象是____________________________
(4)检验绿矾分解产物中含有三价铁,应选用的实验仪器有试管、胶头滴管、_______;选用的试剂为____________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
周期表前四周期元素R、X、Y、Z原子序效依次增大,RO2是红棕色气体:X位于元素周期表ⅣB族:同周期元素的基态原子中,Y的未成对电子最多;基态Z+最外层有18个电子。请回答下列问题:
(l)基态Y原子的价层电子轨道示意图为__________。
(2) RO3-的立体构型是______________,写出两个与RO3- 其有相同空间构型和键合形式的分子或离子____________。
(3) R及与R相邻的同周期元素中,第一电离能最大的是____(填元素符号), 原因是_____。
(4)若过渡金属离子具有未成对d电子,容易吸收可见光而发生d-d跃迁,因而它们的水合离子常常具有颜色;若过渡金属离子无未成对d电子,则其水合离子是无色的。下列水合离子为无色的是_____
A. X2+ B.X4+ C. Y3+ D. Z2+
(5)右图是Z与金的一种合金晶体的立方晶胞:
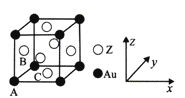
① 该晶体中,Z与Au的原子个数比为_________;
② 原子坐标参数可表示晶胞内各原子的相对位置。图示晶胞中,原子坐标参数A为(0, 0,0 );
B为(0,1/2,1/2)则C原子(底心)的坐标参数为__________。
③ 已知该立方晶胞的密度为dg/cm3 ,NA为阿伏伽德罗常数的值,则晶胞参数(描述晶胞的大小和形状)a=_______nm。(列出表达式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把含有氧化铁的铁片投入到足量的稀硫酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且生成的Fe2+与反应生成的H2的物质的量之比为3︰1,则原混合物中Fe2O3与Fe的物质的量之比为( )
A. 1︰1 B. 2︰5 C. 4︰1 D. 3︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是指粒子直径在1~100nm之间的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,对所形成的分散系说法正确的是:(1)是溶液;(2)是胶体;(3)能产生丁达尔效应;(4)能通过滤纸;(5)不能通过滤纸;(6)静置后会析出黑色的沉淀。
A.(1)(4)(6) B.(2)(3)(4)
C.(2)(3)(5) D.(3)(4)(6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是国际上七个基本物理量之一,下列叙述中正确的是( )
A.1mol H2的体积为22.4L
B.1mol OH﹣的质量18克
C.CO的摩尔质量是28g/mol
D.0.1mol/L的盐酸中含有1mol H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),不同温度下达到平衡时,反应体系中各物质的浓度如下表:
CO(g)+3H2(g),不同温度下达到平衡时,反应体系中各物质的浓度如下表:
温度 | CH4(g) | H2O(g) | CO(g) | H2(g) |
500K | 0.8mol/L | 0.8mol/L | 0.2mol/L | 0.6mol/L |
800K | 0.6mol/L | 0.6mol/L | 0.4mol/L | 1.2mol/L |
1000K | 0.4mol/L | 0.4mol/L | 0.6mol/L | 1.8mol/L |
(1)该反应的平衡常数表达式为K=______________,正反应为_________反应(填放热、吸热)。
(2)能判断该反应是否已达到化学平衡状态的依据是_________
a.容器压强不变 b.c(CH4)=c(H2O)
c.v正(CH4)=v逆(H2) d .混合气体中c(CO)不变
氮化铝是共价键化合物,高碳热还原制备氮化铝的总反应化学方程式为(未配平):
Al2O3(s)+C(s)+N2(g)→AlN(s)+CO(g) ……①
某氮化铝样品中含有氧化铝杂质.已知氮化铝和NaOH溶液能反应,并产生氨气,其反应方程式为:AlN+NaOH+H2O→NaAlO2+NH3↑……②,
氧化铝也能与氢氧化钠溶液反应而全部溶解……③
(3)配平化学化学方程式①:___Al2O3(s)+ C(s)+ N2(g)→ AlN(s)+ CO(g)
(4)反应②中产生气体的检验方法为____________________________________________;
反应③的离子方程式___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.Al(OH)3可用于制胃酸中和剂
B.Na2O2与水反应、红热的Fe与水蒸气反应均能生成碱
C.在AlCl3溶液中加入过量的NaOH溶液可制得Al(OH)3沉淀
D.NaHCO3、Na2CO3、Fe(OH)3三种固体受热后均能生成气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:

实验步骤:
在A中加入4.4 g的异戊醇、6.0 g的乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的名称是______。
(2)在洗涤操作中,第一次水洗的主要目的是____________,第二次水洗的主要目的是___________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后______(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是________________。
(5)实验中加入少量无水MgSO4的目的是___________。
(6)在蒸馏操作中,仪器选择及安装都正确的是______(填标号)。

(7)本实验的产率是______(填标号)。
a.30℅ b.40℅ c.60℅ d.90℅
(8)在进行蒸馏操作时,若从130 ℃便开始收集馏分,会使实验的产率偏__(填“高”或“低”), 原因是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com