
【题目】在一定体积的密闭容器中,进行如下化学反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),不同温度下达到平衡时,反应体系中各物质的浓度如下表:
CO(g)+3H2(g),不同温度下达到平衡时,反应体系中各物质的浓度如下表:
温度 | CH4(g) | H2O(g) | CO(g) | H2(g) |
500K | 0.8mol/L | 0.8mol/L | 0.2mol/L | 0.6mol/L |
800K | 0.6mol/L | 0.6mol/L | 0.4mol/L | 1.2mol/L |
1000K | 0.4mol/L | 0.4mol/L | 0.6mol/L | 1.8mol/L |
(1)该反应的平衡常数表达式为K=______________,正反应为_________反应(填放热、吸热)。
(2)能判断该反应是否已达到化学平衡状态的依据是_________
a.容器压强不变 b.c(CH4)=c(H2O)
c.v正(CH4)=v逆(H2) d .混合气体中c(CO)不变
氮化铝是共价键化合物,高碳热还原制备氮化铝的总反应化学方程式为(未配平):
Al2O3(s)+C(s)+N2(g)→AlN(s)+CO(g) ……①
某氮化铝样品中含有氧化铝杂质.已知氮化铝和NaOH溶液能反应,并产生氨气,其反应方程式为:AlN+NaOH+H2O→NaAlO2+NH3↑……②,
氧化铝也能与氢氧化钠溶液反应而全部溶解……③
(3)配平化学化学方程式①:___Al2O3(s)+ C(s)+ N2(g)→ AlN(s)+ CO(g)
(4)反应②中产生气体的检验方法为____________________________________________;
反应③的离子方程式___________________________________________________________。
【答案】 c(CO)c(H2)3/c(CH4)c(H2O) 吸热 ad 1Al2O3(s)+3C(s)+1N2(g)→2AlN(s)+3CO(g) 湿润的红色石蕊试纸检验,试纸变蓝证明有氨气(或用玻璃棒蘸浓盐酸或者浓硝酸靠近,产生白烟,证明有氨气) Al2O3 + 2OH–=2AlO2– +H2O
【解析】(1)本题考查化学平衡常数的计算以及影响化学平衡常数的因素,根据化学平衡常数的定义,K=c3(H2)×c(CO)/[c(CH4)×c(H2O)],当温度等于500K时,K=0.63×0.2/0.82=0.0675,800K时,K=1.23×0.4/0.62=1.92,温度升高,化学平衡常数增大,说明温度升高,平衡向正反应方向移动,即正反应方向是吸热反应;(2)a、反应前后气体系数之和不相等,因此当压强不变时,说明反应达到平衡,故a正确;b、CH4和H2O的系数相等,开始时如果充入的CO2和H2O的量相同,则反应任何时刻两者浓度都相等,因此c(CH4)=c(H2O)时不能说明反应达到平衡,故b错误;c、用不同物质的反应速率判断达到平衡,要求反应方向一正一逆,且反应速率之比等于化学计量数之比,即3v正(CH4)=v逆(H2) ,故c错误;d、根据化学平衡状态的定义,当组分的浓度不再改变,说明反应达到平衡,故d正确;(3)根据反应方程式,C的化合价由0价→+2价,化合价升高2价,N的化合价降低,由0价→-3价,N2整体化合价降低6价,最小公倍数为6,然后根据原子守恒配平其他,即反应方程式为Al2O3(s)+3C(s)+N2(g)=2AlN(s)+3CO(g);(4)②中的气体为NH3,检验氨气常利用其水溶液显碱性,即湿润的红色石蕊试纸检验,试纸变蓝证明有氨气,或者NH3和挥发性酸反应生成白烟,即用玻璃棒蘸浓盐酸或者浓硝酸靠近,产生白烟,证明有氨气;反应③中氧化铝表现两性,即离子反应方程式为Al2O3+2OH-=2AlO2-+H2O。


科目:高中化学 来源: 题型:
【题目】用A、B、C三个装置都可以制取溴苯,其中A是最基本的制备装置,B、C是改进后的装置,请仔细分析、对比三套装置,然后回答以下问题:

(1)写出三个装置中都发生的发应的化学方程式:__________、___________。
(2)装置A和C中均采用了长玻璃导管,其作用是_____________________________。
(3)装置B和C较好地解决了装置A中存在的加药品和及时密封的矛盾,方便了操作。装置A中这一问题在实验中易造成的不良后果是________________________________。
(4)装置B中采用了洗气瓶吸收装置,其作用是_______________________。
(5)装置B中也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是
___________________________、________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿是铜矿的主要品种之一传统的火法冶炼在资源的综合利用、环境保护等方面会遇到困难。辉铜矿的湿法冶炼目前国内外都处于探索阶段。自氧化还氨氮分离法是一种较为理想的湿法冶炼方法,工艺流程如下图所示:
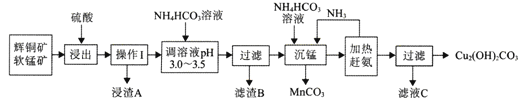
已知:
① 辉铜矿的主要成分是Cu2S,含有较多的Fe2O3、SiO2等。
② 软锰矿的主要成分是MnO2,含有较多的SiO2等。
③ 浸出时,生成一种非金属单质。
④ 室温下,Kap[Fe(OH)3]=4.0×10-38mol/L,Kap[Fe(OH)2]=8.0×10-16mol/L
完成下列填空:
(l)浸出前需要先将矿石粉碎,其目的是__________。
(2)写山浸出时主要反应的离子方程式_____________。
(3)浸渣A的主要成分为_______;调溶液pH 3.0-3.5的目的是除去______离子;室温下,若该离子的浓度为4.0×10-8mol/L,则溶液的pH=__________。
(4) 工业上可将MnCO3、在300℃左右氧化来制取具有较好催化性能的MnO2,则MnCO3在空气中受热制取MnO2的化学方程式为_________________。
(5)从滤液C中提取硫酸氨晶体的步骤为_______、_______、过滤、洗涤、干操。
(6)与火法冶炼辉铜矿相比,用图中方法冶炼辉铜矿的优点有________、_____。(列举其中2条)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2气体分别通入下列四种溶液中,有关现象及结论的说法正确的是
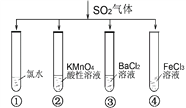
A. 试管①中有淡黄色沉淀生成,说明SO2有氧化性
B. 试管②中溶液褪色,说明SO2有漂白性
C. 试管③中能产生白色沉淀,说明SO2有酸性
D. 试管④中溶液颜色变浅,说明SO2有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的溶液中可以大量共存的离子组是( )
A. Ca2+ Na+ CO32- Cl- B. Na+ K+ CO32- H+
C. Ba2+ Cu2+ SO42- Cl- D. Mg2+ Al3+ Cl- NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(11分)物质H俗称衣康酸,是制备高效粘合剂等多种精细化学品的重要原料,可经下列反应路线得到:
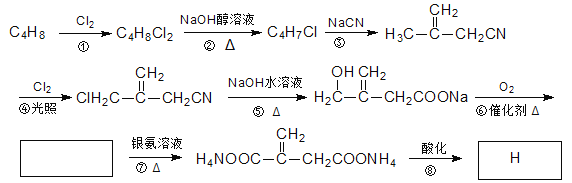
回答下列问题:
(1)C4H8的名称(系统命名)是 。
(2)反应⑥的化学方程式为 。
(3)衣康酸有多种同分异构体,其中与衣康酸属于同类且核磁共振氢谱有5个峰的有机物结构简式为 。
(4)下列关于H的说法正确的是 (填字母)
a.能使酸性KMnO4溶液或溴的CCl4溶液褪色
b.能与Na2CO3反应,但不与HBr反应
c.能与新制Cu(OH)2反应
d.1molH完全燃烧消耗5molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述正确的是( )
A. 植物油不能使溴的四氯化碳溶液褪色
B. 淀粉水解的最终产物是葡萄糖
C. 糖类都能发生氧化反应和水解反应
D. 蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com