
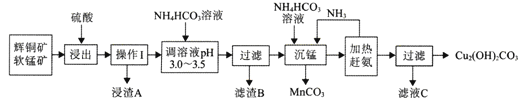
【题目】辉铜矿是铜矿的主要品种之一传统的火法冶炼在资源的综合利用、环境保护等方面会遇到困难。辉铜矿的湿法冶炼目前国内外都处于探索阶段。自氧化还氨氮分离法是一种较为理想的湿法冶炼方法,工艺流程如下图所示:
已知:
① 辉铜矿的主要成分是Cu2S,含有较多的Fe2O3、SiO2等。
② 软锰矿的主要成分是MnO2,含有较多的SiO2等。
③ 浸出时,生成一种非金属单质。
④ 室温下,Kap[Fe(OH)3]=4.0×10-38mol/L,Kap[Fe(OH)2]=8.0×10-16mol/L
完成下列填空:
(l)浸出前需要先将矿石粉碎,其目的是__________。
(2)写山浸出时主要反应的离子方程式_____________。
(3)浸渣A的主要成分为_______;调溶液pH 3.0-3.5的目的是除去______离子;室温下,若该离子的浓度为4.0×10-8mol/L,则溶液的pH=__________。
(4) 工业上可将MnCO3、在300℃左右氧化来制取具有较好催化性能的MnO2,则MnCO3在空气中受热制取MnO2的化学方程式为_________________。
(5)从滤液C中提取硫酸氨晶体的步骤为_______、_______、过滤、洗涤、干操。
(6)与火法冶炼辉铜矿相比,用图中方法冶炼辉铜矿的优点有________、_____。(列举其中2条)
【答案】 增大与酸的接触面积,加快反应速率(或提高浸出效率)(合理即可) Cu2S+2MnO2+8H+=Cu2++S+2Mn2++4H2O SiO2、S Fe3+ 4 2MnCO3+O2![]() 2MnO2+2CO2 蒸发浓缩 冷却结晶 实现资源的综合利用 不产生污染环境的气体、能耗低等(合理即可)
2MnO2+2CO2 蒸发浓缩 冷却结晶 实现资源的综合利用 不产生污染环境的气体、能耗低等(合理即可)
【解析】(1)酸浸时矿石颗粒大小影响浸取速率;(2)根据信息,MnO2能将金属硫化物中的硫氧化为单质硫,反应物是Cu2S、MnO2、H2SO4,生成物是CuSO4、MnSO4、S;(3)根据金属阳离子生成氢氧化物沉淀的pH范围判断;根据氢氧化铁的溶度积计算氢离子浓度,再计算PH; (4)MnCO3、氧气在300℃左右反应生成MnO2、二氧化碳;(5)从溶液获得晶体的步骤为蒸发浓缩、冷却结晶过、滤、洗涤、干操;;(6) 火法冶炼辉铜矿生成二氧化硫气体。
解析:(1)将矿石粉碎能增大与酸的接触面积,加快反应速率;(2)根据信息,MnO2能将金属硫化物中的硫氧化为单质硫,反应物是Cu2S、MnO2、H2SO4,生成物是CuSO4、MnSO4、S,把硫化亚铜看成整体,化合价变化是:(1×2+2×1)=4,Mn元素化合价变化是:4-2=2,根据化合价升降规律,浸出时主要反应的离子方程式Cu2S+2MnO2+8H+=Cu2++S+2Mn2++4H2O;(3)
SiO2与硫酸不反应,浸渣A的主要成分为SiO2,还有浸出反应生成的S单质;根据金属阳离子生成氢氧化物沉淀的pH范围使Fe3+完全沉淀且Cu2+不沉淀的PH范围是:3.2~4.4,故选择PH=4目的是使Fe3+完全水解生成氢氧化铁沉淀;根据氢氧化铁的溶度积![]() ,
, ![]() ,所以PH=4; (4)MnCO3、氧气在300℃左右反应生成MnO2、二氧化碳,方程式为2MnCO3+O2
,所以PH=4; (4)MnCO3、氧气在300℃左右反应生成MnO2、二氧化碳,方程式为2MnCO3+O2![]() 2MnO2+2CO2 ;(5)从溶液获得晶体的步骤为蒸发浓缩、冷却结晶过、滤、洗涤、干操;(6) 火法冶炼辉铜矿生成二氧化硫气体,用图中方法不产生污染环境的气体、能耗低。
2MnO2+2CO2 ;(5)从溶液获得晶体的步骤为蒸发浓缩、冷却结晶过、滤、洗涤、干操;(6) 火法冶炼辉铜矿生成二氧化硫气体,用图中方法不产生污染环境的气体、能耗低。


科目:高中化学 来源: 题型:
【题目】化学镀镍是指不使用外加电流,利用氧化还原作用在金属制件的表面上沉积一层镍的方法。次磷酸钠(NaH2PO2)是化学镀镍的重要原料,工业上制备NaH2PO2·H2O的流程如下:

回答下列问题:
⑴次磷酸钠(NaH2PO2)是次磷酸(H3PO2)与足量NaOH溶液反应的产物,NaH2PO2属于_______(填“正盐”“酸式盐”“碱式盐”), NaH2PO2中磷元素的化合价为___________。
(2)在反应器中加入乳化剂并高速搅拌的目的是________________
(3)在反应器中发生多个反应,其中白磷(P4)与Ca(OH)2反应生成次磷酸钠及磷化氢的化学方程式为_________________________
(4)流程中通入CO2的目的是______________,滤渣X的化学式为_____________
(5)流程中母液中的溶质除NaH2PO2外,还有的一种主要成分为_____________
(6)含PH3的废气可用NaClO和NaOH的混合溶液处理将其转化为磷酸盐,该反应的离子方程式为____________
(7)某次生产投入的原料白磷为1240 kg,在高速乳化反应器中有80%的白磷转化为次磷酸钠及磷化氢,忽略其它步骤的损失,理论上最终得到产品NaH2PO2·H2O的质量应为__________kg(NaH2PO2·H2O的相对分子质量为106)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素A、B、C、D的原子序数依次增加。甲、丙、戊是由这些元素组成的二元化合物,丙分子中原子个数比为1:1,乙是元素D的单质,通常为深红棕色液体,丁为淡黄色固体,0.01 mol/L戊溶液的pH为2,己为难溶于水、密度比水大的油状物。上述物质的转化关系如图所示。下列说法中不正确的是
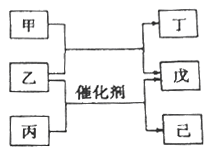
A. 四种元素既不同周期也不同主族
B. 元素的非金属性A<B<C
C. 丙常温常压下为气态
D. C的最高价氧化物对应的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
周期表前四周期元素R、X、Y、Z原子序效依次增大,RO2是红棕色气体:X位于元素周期表ⅣB族:同周期元素的基态原子中,Y的未成对电子最多;基态Z+最外层有18个电子。请回答下列问题:
(l)基态Y原子的价层电子轨道示意图为__________。
(2) RO3-的立体构型是______________,写出两个与RO3- 其有相同空间构型和键合形式的分子或离子____________。
(3) R及与R相邻的同周期元素中,第一电离能最大的是____(填元素符号), 原因是_____。
(4)若过渡金属离子具有未成对d电子,容易吸收可见光而发生d-d跃迁,因而它们的水合离子常常具有颜色;若过渡金属离子无未成对d电子,则其水合离子是无色的。下列水合离子为无色的是_____
A. X2+ B.X4+ C. Y3+ D. Z2+
(5)右图是Z与金的一种合金晶体的立方晶胞:
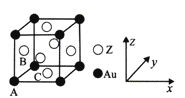
① 该晶体中,Z与Au的原子个数比为_________;
② 原子坐标参数可表示晶胞内各原子的相对位置。图示晶胞中,原子坐标参数A为(0, 0,0 );
B为(0,1/2,1/2)则C原子(底心)的坐标参数为__________。
③ 已知该立方晶胞的密度为dg/cm3 ,NA为阿伏伽德罗常数的值,则晶胞参数(描述晶胞的大小和形状)a=_______nm。(列出表达式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应且焓变大于0的是
A. 灼热的炭与水蒸气反应B. Zn和稀H2SO4反应制氢气
C. Ba(OH)2·8H2O和NH4Cl反应D. HCl溶液和NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把含有氧化铁的铁片投入到足量的稀硫酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且生成的Fe2+与反应生成的H2的物质的量之比为3︰1,则原混合物中Fe2O3与Fe的物质的量之比为( )
A. 1︰1 B. 2︰5 C. 4︰1 D. 3︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是指粒子直径在1~100nm之间的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,对所形成的分散系说法正确的是:(1)是溶液;(2)是胶体;(3)能产生丁达尔效应;(4)能通过滤纸;(5)不能通过滤纸;(6)静置后会析出黑色的沉淀。
A.(1)(4)(6) B.(2)(3)(4)
C.(2)(3)(5) D.(3)(4)(6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),不同温度下达到平衡时,反应体系中各物质的浓度如下表:
CO(g)+3H2(g),不同温度下达到平衡时,反应体系中各物质的浓度如下表:
温度 | CH4(g) | H2O(g) | CO(g) | H2(g) |
500K | 0.8mol/L | 0.8mol/L | 0.2mol/L | 0.6mol/L |
800K | 0.6mol/L | 0.6mol/L | 0.4mol/L | 1.2mol/L |
1000K | 0.4mol/L | 0.4mol/L | 0.6mol/L | 1.8mol/L |
(1)该反应的平衡常数表达式为K=______________,正反应为_________反应(填放热、吸热)。
(2)能判断该反应是否已达到化学平衡状态的依据是_________
a.容器压强不变 b.c(CH4)=c(H2O)
c.v正(CH4)=v逆(H2) d .混合气体中c(CO)不变
氮化铝是共价键化合物,高碳热还原制备氮化铝的总反应化学方程式为(未配平):
Al2O3(s)+C(s)+N2(g)→AlN(s)+CO(g) ……①
某氮化铝样品中含有氧化铝杂质.已知氮化铝和NaOH溶液能反应,并产生氨气,其反应方程式为:AlN+NaOH+H2O→NaAlO2+NH3↑……②,
氧化铝也能与氢氧化钠溶液反应而全部溶解……③
(3)配平化学化学方程式①:___Al2O3(s)+ C(s)+ N2(g)→ AlN(s)+ CO(g)
(4)反应②中产生气体的检验方法为____________________________________________;
反应③的离子方程式___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016年浙江卷】下列说法正确的是
A.![]() 的一溴代物和
的一溴代物和![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B.CH3CH=CHCH3分子中的四个碳原子在同一直线上
C.按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D.![]() 与
与![]() 都是α-氨基酸且互为同系物
都是α-氨基酸且互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com