
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。
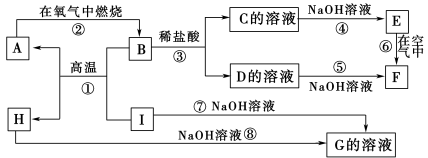
已知:H为两性氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
⑴A、B、C、D、E、F六种物质中所含的同一种元素的是 。
⑵写出反应①的化学方程式: 。
⑶写出反应③的离子方程式: 。
⑷反应⑥过程中的现象是: 。
【答案】(1)铁元素
(2)8Al+3Fe3O4![]() 4Al2O3+9Fe
4Al2O3+9Fe
(3)Fe3O4+8H+=Fe2++2Fe3++4H2O
(4)生成的白色沉淀在空气中迅速变成灰绿色,最后变成红褐色
【解析】
试题分析:H为主族元素的固态氧化物,H能和氢氧化钠溶液反应生成G,则H是Al2O3,I能和氢氧化钠溶液反应生成G,则I是Al,G是NaAlO2,Al和B能在高温下反应生成A,A能在氧气中燃烧生成B,铝在高温下能发生铝热反应,则B是金属氧化物,A是金属单质,B和盐酸反应生成C和D,C和氢氧化钠反应生成E,D和氨水反应生成F,E在空气中反应生成F,说明E不稳定,易被氧气氧化,且A、B、C、D、E、F六种物质中均含同一种元素,则A是Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3;
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是铁;
(2)反应①是高温下铝和四氧化三铁反应生成氧化铝和铁,反应方程式为:8Al+3Fe3O4![]() 4Al2O3+9Fe;
4Al2O3+9Fe;
(3)反应③的离子方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O;
(4)反应⑥是氢氧化亚铁不稳定易被氧气氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,反应现象是生成白色沉淀迅速变化为灰绿色最后变化为红褐色。


科目:高中化学 来源: 题型:
【题目】一个由锌片和石墨棒作为电极的原电池如图所示,电极反应分别是:
锌片:2Zn﹣4e﹣+4OH﹣═2ZnO+2H2O 石墨:2H2O+O2+4e﹣═4OH﹣
下列说法中不正确的是( )

A.电子从石墨经外电路流向锌片,电解质溶液为酸性溶液
B.锌片是负极,石墨是正极
C.电池总反应为2Zn+O2═2ZnO
D.该原电池工作一段时间后石墨附近溶液中的c(OH﹣)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度为0.1000mol/L的氢氧化钠溶液分别滴定20. 00mL浓度均为0.l000mol/L的两种酸HX、HY(忽略体积变化),实验数据如下表,下列判断不正确的是
数据编号 | 滴入NaOH(aq) 的体积/mL | 溶液的pH | |
HX | HY | ||
① | 0 | 3 | 1 |
② | a | 7 | x |
③ | 20.00 | >7 | y |
A. 在相同温度下,同浓度的两种酸溶液的导电能力:HX<HY
B. 由表中数据可估算出Ka(HX)≈10-5
C. HY和HX混合,c(H+)=c(X一)+c(Y一)+c(OH一)
D. 上述②反应后的HY溶液中:c(Na+)>c(Y一)>c(OH一)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚砂(SiC)可由SiO2和碳在一定条件下反应制得,反应方程式为SiO2+3C![]() SiC+2CO↑,下列有关制造金刚砂的说法中正确的是
SiC+2CO↑,下列有关制造金刚砂的说法中正确的是
A. 该反应中的氧化剂是SiO2,还原剂为C
B. 该反应中的氧化产物和还原产物的物质的量之比为1∶2
C. 该反应中转移的电子数为12e-
D. 该反应中的还原产物是SiC、氧化产物是CO,其物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于药品的保存方法不正确的是( )
A. 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
B. 硅酸钠溶液应保存在带橡胶塞的试剂瓶中
C. 液溴易挥发,在存放溴的试剂瓶中应加水封
D. 浓硝酸存放在带有玻璃塞的棕色试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的CO和CH4分别在足量的O2中完全燃烧,消耗O2的体积分别为xL和yL,则x与y的比值为( )
A. 1:4 B. 4:7 C. 1:7 D. 7:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一容积为5 L的体积不变的密闭容器内,加入 0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图:
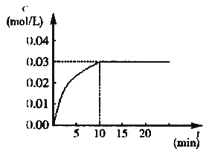
(1)根据图上数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)= mol/(L·min),该温度(800℃)下的平衡常数K= 。
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有 (填字母)
A.升高温度
B.降低温度
C.增大压强
D.减小压强
E.加入催化剂
G.移出一氧化碳气体
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)=___________mol/L。
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,H2O的转化率_____________(填“升高”、“降低”还是“不变”)。
(5)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L,c(CO2 )=c(H2)=0.13mol/L,则此反应是否处于平衡状态: (填“是”或“否”),若没有处于平衡状态则该反应向 方向移动。(填“正反应”或“逆反应”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的一种1∶2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有________种不同运动状态的电子,基态T原子有________种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为________(用元素符号表示)。
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为__________________。
(4)Z与R能形成化合物甲,1 mol甲中含________ mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为_________________________。
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为___________________。
氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
熔点/K | 993 | 1 539 | 183 |
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应过程中的离子方程式
为________________________;________________________。
(7)X单质的晶胞如图所示,一个X晶胞中有________个X原子;
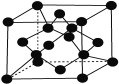
若X晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则该晶胞的体积为________ cm3 (用代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com