
【题目】【化学——选修3:物质结构与性质】原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的一种1∶2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有________种不同运动状态的电子,基态T原子有________种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为________(用元素符号表示)。
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为__________________。
(4)Z与R能形成化合物甲,1 mol甲中含________ mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为_________________________。
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为___________________。
氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
熔点/K | 993 | 1 539 | 183 |
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应过程中的离子方程式
为________________________;________________________。
(7)X单质的晶胞如图所示,一个X晶胞中有________个X原子;
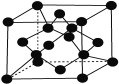
若X晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则该晶胞的体积为________ cm3 (用代数式表示)。
【答案】(1)7(1分) 7(1分) (2)C<O<N(1分) (3)sp杂化(1分)
(4)4(1分) SiF4为正四面体形(1分)、H2O为V形(1分)
(5)NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点最低;Mg2+的半径比Na+的半径小、电荷数多,晶格能:MgF2>NaF,故MgF2的熔点比NaF高(2分)
(6)Cu2++2NH3·H2O===Cu(OH)2↓+2NH![]() (2分)、
(2分)、
Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-(2分) (7)8 (1分) 96/ρNA(1分)
【解析】
试题分析:X的一种氢化物分子中既有σ键又有π键,说明分子里有双键或参键,X的一种氢化物为1:2型且所有原子共平面,所以X应为C元素,它的1:2型氢化物为乙烯;Z的L层上有2个未成对电子,即核外电子排布为1s22s22p2或1s22s22p4,X、Y、Z原子序数依次增大,所以Z为O元素,且Y为N元素;Q原子s能级与p能级电子数相等,则Q的核外电子排布为1s22s22p4或1s22s22p63s2,由于Q的原子序数比氧大,所以Q的电子排布为1s22s22p63s2,即Q为Mg;而G为金属元素,且原子序数介于氧和镁元素之间,所以G为Na;R单质是制造各种计算机、微电子产品的核心材料,则R为Si;T处于周期表的ds区,原子中只有一个未成对电子,价电子排布为3d104s1,故T为Cu;
(1)Y为N元素,核外电子排布式为1s22s22p3,所以7种不同运动状态的电子;T为Cu元素,它的核外电子排布式为:1s22s22p63s23p63d104s1,所以它有7个能级;
(2)C、N、O位于元素周期表同一周期,同周期随原子序数增大,第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:C<O<N;
(3)OCN-与CO2互为等电子体,所以它们结构相似,OCN-中C原子与O、N原子之比分别形成2对共用电子对,没有孤电子对,所以碳的杂化方式为sp杂化;
(4)Z与R能形成化合物甲为二氧化硅,在二氧化硅晶体中,每个硅原子周围有四个Si-O键,所以1mol二氧化硅中含有4molSi-O键;SiO2与HF反应的方程式为:SiO2+4HF=SiF4+2H2O,其中SiF4中硅原子的价层电子对数为:4+![]() =4,没有孤对电子,所以SiF4的空间构型为正四面体、H2O为V形;
=4,没有孤对电子,所以SiF4的空间构型为正四面体、H2O为V形;
(5)在NaF、MgF2、SiF4中,NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点最低,Mg2+的半径比Na+的半径小,且Mg2+电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高;
(6)向硫酸铜溶液中逐滴加入氨水溶液至过量,反应生成四氨合铜络离子,反应的离子方程式为:Cu2++4NH3.H2O=[Cu(NH3)4]2++4H2O;
(7)碳单质的晶胞为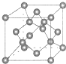 ,晶胞中含有C原子数目为4+8×1/8+6×1/2=8,C原子与周围4个原子形成正四面体,正四面体中心C原子与顶点碳原子相邻,距离最近,晶胞质量为8×12/NAg,晶体的密度为pg/cm3,则晶胞的体积为(8×12/NAg)÷(pg/cm3)=96/ρNA。
,晶胞中含有C原子数目为4+8×1/8+6×1/2=8,C原子与周围4个原子形成正四面体,正四面体中心C原子与顶点碳原子相邻,距离最近,晶胞质量为8×12/NAg,晶体的密度为pg/cm3,则晶胞的体积为(8×12/NAg)÷(pg/cm3)=96/ρNA。


科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。
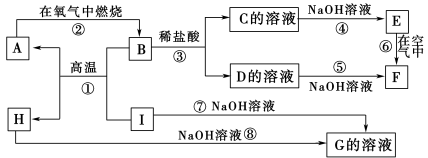
已知:H为两性氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
⑴A、B、C、D、E、F六种物质中所含的同一种元素的是 。
⑵写出反应①的化学方程式: 。
⑶写出反应③的离子方程式: 。
⑷反应⑥过程中的现象是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①![]() ,②
,②![]() ,③
,③![]() ,下列说法正确的是
,下列说法正确的是
A. 上述三个反应都有单质生成,所以都是置换反应
B. 氧化性由强到弱顺序为![]()
C. 反应②中还原剂与氧化剂的物质的量之比为6:1
D. ③中![]() 还原剂反应则氧化剂得到电子的物质的量为
还原剂反应则氧化剂得到电子的物质的量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容密闭容器中,当下列哪些量不再发生变化时,表明下述反应:
A(s)+2B(g)![]() C(g)+D(g)已达到平衡状态:
C(g)+D(g)已达到平衡状态:
①混合气体的压强 ②混合气体的密度
③B的物质的量浓度④气体的总物质的量
⑤混合气体的平均相对分子质量
⑥物质C的百分含量 ⑦各气体的物质的量
⑧当有1molB气体分子断键,同时有1/2molC气体分子断键
A.②③⑤⑥⑦⑧ B.①②③⑥⑦⑧ C.②③④⑤⑥⑧ D.①③④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量相等的A、B两种气体,下列说法中错误的是( )
A. 分子数目一定相等
B. 体积一定相等
C. 质量不一定相等
D. 分子中的原子数目可能相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
下列说法中错误的是( )
A.①②中除加试剂外,还需要进行过滤操作
B.a、b中铝元素的化合价相同
C.③中需要通入过量的氨气
D.④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备。
①用肼(N2H4)作燃料,四氧化二氮作氧化剂,两者反应生成氮气和气态水。
已知: N2(g)+2O2(g)===N2O4(g) ΔH=+10.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应生成氮气和气态水的热化学方程式:________________________。
②已知四氧化二氮在大气中或在较高温度下很难稳定存在,它很容易转化为二氧化氮。试推断出二氧化氮制取四氧化二氮的反应条件(或措施): ____________________。
(2)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g)![]() 2NH3(g) △H=bkJmol﹣1,其化学平衡常数K值和温度的关系如下:
2NH3(g) △H=bkJmol﹣1,其化学平衡常数K值和温度的关系如下:
温度/℃ | 200 | 300 | 400 |
K | 1.0 | 0.86 | 0.5 |
写出该反应的化学平衡常数的表达式: ,b 0(填“大于”、“小于”或“等于”)
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2) v逆(N2)(填“大于”、“小于”或“等于”)
(3)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e-===2O2-)。

①c电极的名称为________,d电极上的电极反应式为______________________。
②如图2所示为用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为___________________。若a电极产生56 mL(标准状况)气体,则所得溶液的pH=__________(不考虑溶液体积变化) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 依据酸碱质子理论,NaHCO3是两性物质
B. 可用电解饱和食盐水法制取金属钠
C. 钠可从TiCl4溶液中置换出Ti
D. 氢氧燃料电池工作时实现了电能转换为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
A.将NaHCO3固体加入新制氯水中,有无色气泡(H+)
B.使红色布条褪色(HCl)
C.向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈红色(Cl2)
D.滴加AgNO3溶液生成白色沉淀(Cl﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com