
以甲基橙为指示剂,用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水,
滴定过程中不可能出现的结果是( )
A.c(NH4+)>c(Cl-),c(OH-)>c(H+)
B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
C.c(Cl-)>c(NH4+),c(OH-)>c(H+)
D.c(Cl-)>c(NH4+),c(H+)>c(OH-)
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷一(解析版) 题型:选择题
符合前者条件的溶液中一定可以大量共存的离子组是( )
A.既能溶解Al(OH)3,又能溶解H2SiO3的溶液:Na+、Fe2+、SO42-、Cl-
B.能使酚酞溶液变红的溶液:Na+、NO3-、S2-、Br-
C.投入铁片能产生H2的无色溶液:H+、Mg2+、SO42-、NO3-
D.含有大量Fe3+的溶液:Na+、Al3+、NO3-、SCN-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-4练习卷(解析版) 题型:选择题
将氨水滴加到盛有AgCl浊液的试管中,AgCl逐渐溶解,再加入NaBr溶液又产生了浅
黄色沉淀。对上述过程,下列理解或解释中正确的是( )
A.Ksp(AgCl)<Ksp(AgBr)
B.若在AgCl浊液中直接加入NaBr溶液,也会产生浅黄色沉淀
C.上述实验说明AgCl没有NaBr稳定
D.因为Ksp(AgCl)>Ksp(AgOH),故氨水能使AgCl溶解
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-3练习卷(解析版) 题型:选择题
向含有等物质的量的NH4+、Al3+、H+的混合溶液中,慢慢滴加NaOH溶液直至过量,
并不断搅拌,依次发生了数个离子反应,则第三个离子反应是( )
A.H++OH-=H2O
B.Al3++3OH-=Al(OH)3↓
C.Al(OH)3+OH-=AlO2-+2H2O
D.NH4++OH-=NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-2练习卷(解析版) 题型:填空题
已知:常温下,A酸的溶液pH=a,B碱的溶液pH=b。
(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液的pH为 。
a.大于7 b.等于7 c.小于7
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为 mol/L,B溶液中水电离出的氢离子浓度为 mol/L。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-2练习卷(解析版) 题型:选择题
下列液体均处于25 ℃,有关叙述正确的是( )
A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐
B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
C.25 ℃时,用pH试纸测定出某醋酸溶液的pH=3.50
D.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在:K+、Na+、AlO2-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-1练习卷(解析版) 题型:选择题
下列关于电解质溶液的叙述正确的是( )
A.常温下,由0.1 mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在:BOH B++OH-
B++OH-
B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-)
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练7-3练习卷(解析版) 题型:选择题
在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)  2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是( )
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是( )
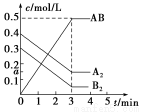
A.图中a点的值为0.15
B.该反应的平衡常数K=0.03
C.温度升高,平衡常数K值减小
D.平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练6-1练习卷(解析版) 题型:选择题
下列有关热化学方程式及其叙述正确的是( )
A.氢气的燃烧热为285.5 kJ·mol·-1,则水分解的热化学方程式为:2H2O(l)=2H2+O2(g)ΔH=+285.5 kJ·mol-1
B.已知2C(石墨,s)+O2(g)=2CO(g)ΔH=-221 kJ·mol-1,则石墨的燃烧热为110.5 kJ·mol-1
C.已知N2(g)+3H2(g)  2NH3(g)ΔH=-92.4 kJ·mol-1,
2NH3(g)ΔH=-92.4 kJ·mol-1,
则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后最多可放出92.4 kJ的热量
D.已知乙醇和乙烯的燃烧热分别为1 366.8 kJ·mol-1和1 411.0 kJ·mol-1,则乙烯水化制乙醇的热化学方程式为:C2H4(g)+H2O(l)=C2H5OH(l) ΔH=-44.2 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com