
 已知制备甲醇的有关化学反应及平衡常数如表所示:
已知制备甲醇的有关化学反应及平衡常数如表所示:| 化学反应 | 反应热 | 平衡常数(850℃) |
| ①CO2 (g)+3H2 (g)═CH3OH(g)+H2O(g) | △H1=-48.8 kJ•molˉ1 | K1=320 |
| ②CO(g)+H2O(g)═H2(g)+CO2(g) | △H2=-41.2 kJ•molˉ1 | K2 |
| ③CO(g)+2H2(g)═CH3OH(g) | △H3 | K3=160 |
| 物质 | H2 | CO2 | CH3OH | H2O |
| 浓度(mol•Lˉ1) | 0.2 | 0.2 | 0.4 | 0.4 |
分析 (1)根据盖斯定律,将①+②=③,据此计算△H3;将反应③-①可得反应②,则平衡常数有K2=$\frac{{K}_{3}}{{K}_{1}}$,据此计算;
(2)(Ⅰ)根据v=$\frac{△c}{△t}$计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2);
(Ⅱ)计算此时的浓度商Qc,与平衡常数相比判断反应进行方向,据此判断速率大小;
(Ⅲ)容器的体积缩小一半,压强增大,平衡向体积减小的方向移动;平衡常数只受温度影响,温度不变,平衡常数不变.
解答 解:(1)根据盖斯定律,将①+②=③,所以△H3=△H1+△H2═-48.8 kJ•molˉ1+(-41.2 kJ•molˉ1)=-90 KJ/mol,将反应③-①可得反应②,则平衡常数有K2=$\frac{{K}_{3}}{{K}_{1}}$=$\frac{160}{320}$=0.5,
故答案为:-90;0.5;
(2)(Ⅰ)由表中数据可知,l0min内甲醇的浓度变化为0.4mol/L,故v(CH3OH)=$\frac{0.4mol/L}{10min}$=0.04mol/(L•min),速率之比等于化学计量数之比,故v(H2)=3v(CH3OH)=3×0.04mol/(L•min)=0.12mol/(L•min),
故答案为:0.12mol/(L•min);
(Ⅱ)10min时,CO2的浓度为0.2mol/L,氢气的浓度为0.2mol/L,甲醇的浓度为0.4mol/L,水的浓度为0.4mol/L,故此时的浓度商Qc=$\frac{0.4×0.4}{0.{2}^{3}×0.2}$=100,小于平衡常数320,故反应向正反应进行,故v正>v逆,
故答案为:>;
(Ⅲ)容器的体积缩小一半,压强增大,平衡向体积减小的方向移动,故平衡向正反应移动;平衡常数只受温度影响,与压强无关,温度不变,平衡常数不变;
故答案为:正向;不变;
(3)反应①是放热反应,反应达到一定温度才可以发生反应,开始反应,甲醇物质的量增大,达到平衡状态,继续升温,平衡逆向进行,甲醇物质的量减小,画出的图象为: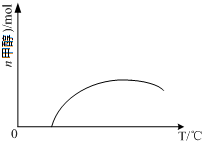 ,
,
故答案为; .
.
点评 本题考查化学平衡常数及影响因素、意义,反应速率计算等,难度中等,(1)中判断有固体碳参加反应是关键,注意化学平衡常数大小说明反应进行程度,与反应难易无关、与反应速率无关.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙醇和汽油都是可再生能源,所以要大力发展“乙醇汽油” | |
| B. | 甲基丙烯酸甲酯可以发生加成、水解和氧化反应 | |
| C. | 苯和苯甲酸的混合物1mol,完全燃烧消耗O2的分子数为7.5NA | |
| D. | 乙苯能被酸性KMnO4溶液氧化,是因为苯环对侧链上的-CH2-产生了影响,使其变活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1Na2CO3溶液中,c(OH)-=c(H+)+c(HCO3-)+c(H2CO3) | |
| B. | 相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则对于同温、同体积、同pH的HCN和HClO分别与Na0H恰好完全反应时,消耗NaOH的物质的量:HClO<HCN | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到酸性的混合溶液:c(Na+)>c(CH3COO-)>C(H+)>c(OH-) | |
| D. | 向硝酸钠溶液中滴加稀盐酸得到pH=5的混合溶液:c(Na+)=c(NO3-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 反应物 | 甲 | 乙 | 丙 |
| A | 2 | 1 | 1 |
| B | 1 | 2 | 1 |
| A. | A的转化率甲<丙<乙 | B. | A的转化率甲<乙<丙 | ||
| C. | B 的转化率甲>丙>乙 | D. | B的转化率甲<乙<丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ |
| 0.1mol•L-1 NaOH溶液 | pH=11NaOH溶液 | 0.1mo•L-1 CH3COOH 溶液 | pH=3 CH3COOH 溶液 |
| A. | ②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为:c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 由水电离出的c(OH-):①>③ | |
| C. | ③稀释到原来的100倍后,pH与④相同 | |
| D. | ①与③混合,若溶液pH=7,则V(NaOH)>V(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
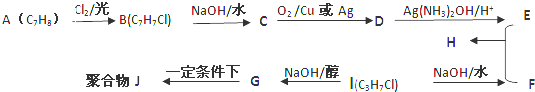
 ,D的官能团名称醛基.
,D的官能团名称醛基. +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O. +CH3CH(OH)CH3$→_{△}^{浓硫酸}$
+CH3CH(OH)CH3$→_{△}^{浓硫酸}$ +H2O.
+H2O.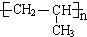 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com