
����Ŀ������һ����Ҫ�Ĺ��ɽ���Ԫ�أ�ͨ�������Ͻ���ֵ����Ӽ�������ǿ�Ͻ��ǿ�ȡ�Ӳ�ȡ��ɺ��Եȡ������ƾ���(Na2MoO4��2H2O)����Ϊ��������ȴˮϵͳ�Ľ�����ʴ���Ƽ�����ͼ15�ǻ����������Ի����(��Ҫ�ɷ�Ϊ����MoS2)Ϊԭ�����Ʊ������⡢�����ƾ������Ҫ����ͼ��

�ش���������:
��1����֪��Ӧ��Ϊ���ֽⷴӦ����������Կ�Ļ��ϼ�Ϊ___________��
��2����Ӧ�������ӷ���ʽΪ___________��
��3�����������ʱ�Ļ�ѧ����ʽΪ____________��
��4������XΪ_________����֪��������һ���¶ȷ�Χ�ڵ��������ʼ���Ӧ���ʵ��ܽ�����±���ʾ�����ڲ���X��Ӧ�����¶ȵ���ѷ�ΧΪ_______(�����)��
�¶�(��) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 | >100 |
�������� | Na2MoO4��10H2O | Na2MoO4��2H2O | Na2MoO4 | ||||||
�ܽ�� | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45.57 | |
A.0�桫10�� B.10�桫100�� C.15.5�桫50�� D.100������
��5���Ʊ������ƾ��廹����ͨ�����ƵĻ������ֱ�Ӽ������������Һ�����ķ����������������У��������������ɣ����������뻹ԭ�������ʵ���֮��Ϊ_________��
��6��Li��MoS2�ɳ���صĹ���ԭ��ΪxLi+nMoS2![]() Lix(MoS2)n[Lix(MoS2)n�����ڵ缫��]�����س��ʱ�����ĵ缫��ӦʽΪ___________________��
Lix(MoS2)n[Lix(MoS2)n�����ڵ缫��]�����س��ʱ�����ĵ缫��ӦʽΪ___________________��
��7�����û�ԭ������(CO��H2)��ԭMoO3���⣬��ҵ���Ʊ���ԭ������CO![]() 2CO+2H2���������������Ϊ90%��7L(��״��)��Ȼ��������������̼�ڸ����·�Ӧ������ת����Ϊ80%,�ò�����CO��H2��ԭMoO3���⣬�������������������Ϊ_________��
2CO+2H2���������������Ϊ90%��7L(��״��)��Ȼ��������������̼�ڸ����·�Ӧ������ת����Ϊ80%,�ò�����CO��H2��ԭMoO3���⣬�������������������Ϊ_________��
���𰸡� +6 MoO3+2OH=![]() +
+![]() 2MoS2+7O2
2MoS2+7O2![]() 2MoO3+4SO2 ����Ũ������ȴ�ᾧ C 9�U1 Lix(MoS2)n xe = nMoS2 +xLi+ 28.8g
2MoO3+4SO2 ����Ũ������ȴ�ᾧ C 9�U1 Lix(MoS2)n xe = nMoS2 +xLi+ 28.8g
����������1����������炙�ѧʽ��֪����Ԫ�ػ��ϼ�Ϊ+6�ۣ����ڷ�Ӧ��Ϊ���ֽⷴӦ������������Ļ��ϼ�Ϊ+6������ȷ����+6��
��2������������ǿ����Һ��Ӧ����Na2MoO4��ˮ����Ӧ�����ӷ���ʽΪMoO3+2OH=![]() +
+![]() ����ȷ����. MoO3+2OH=
����ȷ����. MoO3+2OH=![]() +
+![]() ��
��
��3����������ͼ���������������������������MoO3����ѧ����ʽΪ2MoS2+7O2![]() 2MoO3+4SO2 ����ȷ����2MoS2+7O2
2MoO3+4SO2 ����ȷ����2MoS2+7O2![]() 2MoO3+4SO2��
2MoO3+4SO2��
��4����Na2MoO4��Һ��ΪNa2MoO42H2O���壬��Ҫ���е�����Ũ������ȴ�ᾧ�����ݱ������ݿ�֪Ҫ�γ�Na2MoO42H2O���壬15.5�桫50�� ��Χ�������C��ȷ��.��ȷ��������Ũ������ȴ�ᾧ��C��
��5������������������������ԭΪ�Ȼ��ƣ��������MoS2����ԭ����������ΪNa2MoO4����������ӣ������������xmol��MoS2 ymol�����ݵ����غ������x����1-��-1����=y����6-4+{6-��-2��}��2����x��y=9:1����ȷ�𰸣�9:1��
��6���ŵ�Ϊԭ��������Ϊ���أ�������������������Ӧ��Lix(MoS2)nʧ���ӱ�ΪMoS2���缫��ӦʽΪ Lix(MoS2)n xe = nMoS2 +xLi+ ����ȷ����Lix(MoS2)n xe = nMoS2 +xLi+ ��
��7������CO2��CH4![]() 2CO��2H2��1����ļ��鷢����Ӧ����4����Ļ�ԭ�����������������Ϊ7��90%��80%��4=20.16L������1molMo����3molCO��H2����������n(Mo)= 20.16/��22.4��3��=0.3mol���������Ϊm(Mo)= 0.3��96=28.8 g����ȷ�𰸣�28.8 g��
2CO��2H2��1����ļ��鷢����Ӧ����4����Ļ�ԭ�����������������Ϊ7��90%��80%��4=20.16L������1molMo����3molCO��H2����������n(Mo)= 20.16/��22.4��3��=0.3mol���������Ϊm(Mo)= 0.3��96=28.8 g����ȷ�𰸣�28.8 g��


 �ʰ�Ӣ��ͬ����ϰ��ϵ�д�
�ʰ�Ӣ��ͬ����ϰ��ϵ�д� ѧϰʵ����ϵ�д�
ѧϰʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л������1H�˴Ź�����ͼ�г������鲻ͬ��������� ( )
A. CH3��O��CH3 B. CH3 CH2OH
C. CH3CHO D. CH3COOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����84����Һ�����ճ������б��㷺ʹ�ã�������Һ��ɫ��pH����7����ijЩ��ɫ������Ư�����á���֪��ǿ�������γɵ�����Һ�����ԣ�������Ϊ��84����Һ������Ч�ɷ���(����)
A. �Ȼ��� B. �������� C. ������� D. ̼����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҽ���Ȼ��ƿ������������ơ�������������ҩ��Թ�ҵ̼��ƣ���������MgCl2���ʣ�����ҽҩ���Ȼ��Ƶ���Ҫ�������£�

��ش��������⣺
��1��������������Ҫ���ʵĻ�ѧʽΪ_____���Լ�A��_____��
��2�����������м������������������Һ��Ŀ����_____����������Ӧ�Ļ�ѧ����ʽΪ_____��
��3�����������У������ữ��Ŀ����_____���û�ѧ����ʽ��ʾ����
��4������I��������_____�������������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ֲ���纣���������к��зḻ�ĵ�Ԫ�أ���Ԫ���Ե����ӵ���ʽ���ڡ�ʵ���ҴӺ�������ȡ����������£�
����![]() �����
�����![]() ���������Һ
���������Һ![]()

��1��д����ȡ��Ĺ������й�ʵ����������ƣ���______����________��
��2����ȡ��Ĺ����пɹ�ѡ����л��ܼ�����____��
A�����͡��ƾ� B�����Ȼ�̼������ C�����ᡢ�ƾ�
��3��Ϊ������Ϣ���������������ʵ���������ձ���������������̨����ƿ�����ܡ��ƾ��ƣ���ȱ�ٵIJ���������____________________________________��
��4���Ӻ�����л��ܼ�����ȡ��ͻ����л��ܼ�������Ҫ��������ָ����ͼ��ʾ��ʵ��װ���еĴ���֮������______����________����________����________��

��5��Ϊ���ڿ�������ʱ���¶ȣ�����ʱʹ��ˮԡ���ȣ���������________��ۼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᾧõ�����Ǿ���ǿ��õ�������Ľᾧ�������ϣ������Ϻ����û�����Ʒ�о��й�����Ӧ�ü�ֵ���仯ѧ����Ϊ���������ȼ�����������Ŀǰ���ڹ�ҵ����Ҫʹ������·�����ϳɽᾧõ��:
I.�ɱ���ȩ���ȷºϳ����ȼ������״���
��.���ȼ������״���������������������Ӧ�Ƶ����ᾧ��������
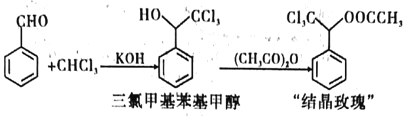
��֪:
���ȼ������״� | ��Է�������:225.5����ɫҺ�塣������ˮ���ܶȱ�ˮ�������Ҵ� |
������ | ��ɫҺ�塣��ˮ��Ӧ�������ᣬ�����Ҵ� |
���ᾧõ���� | ��Է�������:267.5����ɫ���塣�۵�:88����������ˮ�������Ҵ� |
����ʵ�鲽������:
I.�ɱ���ȩ���ȷºϳ����ȼ������״���
����һ:װ����ͼ��ʾ�����ν�����ȩ���ȷ¼���������ƿ��,����A�м���KOH�����ܼ����μ�A���Լ������裬��ʼ��Ӧ��������һ���¶��½��С�

�����:��Ӧ�����������������5%�����ᡢ����ˮϴ�ӡ�
������:��ϴ�Ӻ�Ļ��������ȥ�����л����ʣ�����ˮ����þ�����ˡ���Һ��Ϊ�������ȼ��ͻ��״���
��.���ȼ������״���������������������Ӧ�Ƶ����ᾧõ������
������:����һ����ƿ�м����Ʊ������ȼ������״���������������������Ũ�������Ӧ�����ȿ��Ʒ�Ӧ�¶���90�桫110��֮�䡣
������:��Ӧ��Ϻ���ӦҺ�����ˮ�У���ȴ�ᾧ������ᾧõ������
��ش���������:
��1������A��������_________��ʵ��װ��B�У�����ˮӦ��_____�ڽ�(����a������b��)��
��2��������У���5%������ϴ�ӵ���ҪĿ����___________����ϴ�ӡ���Һ�����У�Ӧ�����Ȼ���ã����ֲ���л���Ӧ___________ (�����)��
A.ֱ�Ӵ��Ͽڵ���
B.�Ƚ�ˮ����Ͽڵ������ٽ��л�����¿ڷų�
C.ֱ�Ӵ��¿ڷų�
D.�Ƚ�ˮ����¿ڷų����ٽ��л�����¿ڷų�
��3���������У�������ˮ����þ��Ŀ����___________����δ������ˮ����þ��ֱ�ӽ������������ʽ��к�����Ӧ����ʹ���ᾧõ�����IJ���ƫ______(����������������),��ԭ����___________ (����ƽ���ƶ�ԭ������)��(��֪���ľ��巴Ӧ��ͼ��ʾ)

��4���������У�����ʱ��Ӧ�ȼ������ȼ������״�����������Ȼ����������Ũ���Ტ���裬��Ҫ��Ϊ��__________�����ȷ�Ӧʱ��Ϊ�ϺõĿ����¶ȣ������˵ļ��ȷ�ʽΪ_____(����ˮԡ������������ԡ������)��
��5��22.55g�����������״���������������ַ�Ӧ�õ��ᾧõ��21.40g,�������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ˮ�����ӻ���25��ʱKw=1��10��14��100��ʱKw=1��10��12���Իش��������⣮
��1��25��ʱ��ijNa2SO4��Һ��c��SO42����=5��10��4 molL��1��ȡ����Һ1mL��ˮϡ����10mL����ϡ�ͺ���Һ��c��Na+����c��OH����=_________��
��2����100��ʱ�����ij��ҺpH=7������Һ��_________�����������������������������ԣ�
��3����100���¶���pH=11��NaOH��Һa L��pH=1��H2SO4��Һb L��ϣ������û��ҺpH=2����a��b=________��
��4��ij�¶�ʱ����pH��2��ϡ�����pH��11��NaOH��Һ�������Ϻ���Һ�����ԣ�����¶���ˮ�����ӻ�����Kw��________��
�ٸ��¶���( T ��)����100 mL 0.1 mol��L��1��ϡH2SO4��Һ��100 mL 0.4 mol��L��1��NaOH��Һ��Ϻ�(��Һ����仯���Բ���)����Һ��pH��____________��
�ڸ��¶���(T ��)��1�����ϡ�����10�����NaOH��Һ��Ϻ���Һ�����ԣ���ϡ�����pH(pHa)��NaOH��Һ��pH(pHb)�Ĺ�ϵ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵���������
A. ���³�ѹ�£�48gO2���е���ԭ����Ϊ3NA
B. 1.7g NH3���е�������ΪNA
C. ��״���£�11.2L�����������Ļ�������еķ�����Ϊ0.5NA
D. 1L 0.1 mol/LCH3CH2OHˮ��Һ�к�Hԭ����ĿΪ0.6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ���������ʵ���Ũ�ȹ�ϵ��ȷ����(����)
A. Ũ�Ⱦ�Ϊ0.1 mol��L��1�İ�ˮ������������Ϻ�c(H��)��c(OH��)��c(NH3��H2O)
B. ��Ũ�ȵ�̼���ơ�̼��������Һ��Ϻ�c(CO![]() )��c(HCO
)��c(HCO![]() )
)
C. ��NaHB��Һ��һ���У�c(Na��)��c(HB��)��2c(B2��)
D. Na2CO3��Һ�У�2c(Na��)��c(CO![]() )��c(HCO
)��c(HCO![]() )��c(H2CO3)
)��c(H2CO3)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com