
| NaNO3 | KNO3 | NaCl | KCl | |
| 10�� | 80.5 | 21.2 | 35.7 | 31.0 |
| 100�� | 175 | 246 | 39.1 | 56.6 |

���� ��1-2�������ƺ��Ȼ��ز�ͬ�¶����ܽ�Ȳ�ͬ���ڢٵ�ʵ������У��������ƺ��Ȼ��ؼ�ˮ�ܽ⣬����Ũ�������Ȼ������������ȹ��˷�����Ȼ��ƣ�����Һ��ȴ��ʹ�����������
��3����Ʒ�п����Ժ�������NaCl��Na+������ɫ��Ӧ��Cl-��AgNO3��Һ��ϡ������飻
��4������������ڵ��º�95%�ľƾ��ܽ�ȱ��Ƚ�С���Լ���������������ˮ�;ƾ���Һ�жϣ�
��5�����ݼ���70gˮ����100��������50gˮ���൱�ڼ���20gˮ����ܽ�Ƚ��м��㣻
��� �⣺��1�������ƺ��Ȼ��ز�ͬ�¶����ܽ�Ȳ�ͬ�������¶ȿ�ʹ���������������ƺ��Ȼ��ؼ�ˮ�ܽ⣬����Ũ�������Ȼ���������AΪ�Ȼ��ƣ����˷�����Ȼ��ƣ�����Һ��ȴ��ʹ�����������CΪ����أ��ʴ�Ϊ�������¶ȣ�C��
��2���ڢٵ�ʵ������У��������ƺ��Ȼ��ؼ�ˮ�ܽ⣬����Ũ�������Ȼ������������ȹ��˷�����Ȼ��ƣ��ʴ�Ϊ����ˮ�ܽ⡢����Ũ�������ȹ��ˣ�
��3����Ʒ�п����Ժ�������NaCl����Na+��Cl-��Na+������ɫ��Ӧ��Cl-��AgNO3��Һ��ϡ������飬�ʴ�Ϊ��Na+��Cl-���ýྻ�IJ�˿����˿պȡ�ֲ�Ʒ�ڻ��������գ�������ʻ�ɫ��֤����Na+���� ȡ�ֲ�Ʒ��������ˮ�����Һ�����������ữ����������Һ�����а�ɫ����������֤����Cl-��
��4�������ܽ�ȱ�����������ڵ��º�95%�ľƾ��ܽ�ȱ��Ƚ�С������������������ˮ�;ƾ���Һ������ϴ�����õ�����ؾ��壬�����ܼ�������ϴ�Ӽ�����bc����ѡ��bc��
��5��ȡ34.0g�����Ƽ�$\frac{34}{85}$=0.4mol��29.8g�Ȼ��ؼ�$\frac{29.8}{74.5}$=0.4mol������70gˮ����100��������50gˮ���൱��ֻ��20gˮ��������ܽ�Ȼ���NaCl��������20gˮ�ܽ�$\frac{39.1}{5}$=7.82g�Ȼ��ƣ����������Ȼ��ƾ��������Ϊ0.4��58.5-7.82=15.58g���ʴ�Ϊ��15.58g��
���� ���⿼�����ʷ��롢�ᴿ��ʵ�鷽����ƣ������������Լ������������Ļ�ѧ��ӦΪ���Ĺؼ�����ȷ���ӵ����ʼ������ķ��롢�ᴿ�������ɽ����Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ռ���Һ | B�� | ����̼��������Һ | ||
| C�� | ����̼������Һ | D�� | �����Ȼ�����Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C6H6 | B�� | C7H8 | C�� | C4H10 | D�� | C3H6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 75%�ľƾ��������� | B�� | Al��OH��3����������θ����� | ||
| C�� | ��������ˮ��ɱ������ | D�� | �Ӻ�����ȡ��ȼ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��NaClO��Һ����Cl2��NaOH��Һ��Ӧ��ã�д���÷�Ӧ�����ӷ���ʽCl2+2OH-=Cl-+ClO-+H2O
��NaClO��Һ����Cl2��NaOH��Һ��Ӧ��ã�д���÷�Ӧ�����ӷ���ʽCl2+2OH-=Cl-+ClO-+H2O�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��H2O | B�� | ���뱥��ʳ��ˮ | ||
| C�� | ����ѹǿ | D�� | �����¶ȣ�����������ӷ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

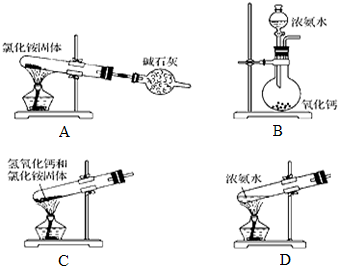
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��M�Ļ�ѧʽΪFeS��F�ĵ���ʽΪ
��M�Ļ�ѧʽΪFeS��F�ĵ���ʽΪ ��
�� ��
���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com