
【题目】下列物质的分类正确的是( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Na2CO3 | H2SO4 | Cu2(OH)2CO3 | Fe2O3 | SO3 |
B | NaOH | HCl | NaCl | Na2O2 | CO |
C | NaOH | NaHSO4 | CaF2 | MgO | SO2 |
D | KOH | HNO3 | NaHCO3 | CaO | CO2 |
A.AB.BC.CD.D
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】铝热反应可用于焊接钢轨,反应为:2Al + Fe2O3 ![]() 2Fe + Al2O3,下列关于该反应说法正确的是
2Fe + Al2O3,下列关于该反应说法正确的是
A. Al 是还原剂 B. Fe2O3 发生氧化反应
C. Fe 是氧化产物 D. 当生成 1 mol Fe 时,转移 6 mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅及其化合物在工业生产、生活中具有非常广泛的用途。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H1=akJ·mol-1
②PbS(s)2PbO(s)=3Pb(s)+SO2(g) △H2=b kJ·mol-1
③PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H3=c kJ·mol-1
反应3PbS(s)+6O2(g)=3PbSO4(s) △H=____________kJ·mol-1(用含a、b、c的代数式表示)
(2)以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制备高纯PbO,其主要流程如下:
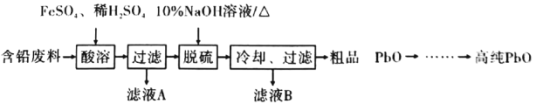
①“酸溶”时,在Fe2+催化下,Pb和PbO2反应成1 mol PbSO4时转移电子的物质的量为_________ mol。
②已知:PbO溶解在NaOH溶液中,存在化学平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图1所示:
NaHPbO2(aq),其溶解度曲线如图1所示:

结合上述信息,完成由粗品PbO(所含杂质不溶于NaOH溶液)得到高纯PbO的操作:将粗品PbO溶解在一定量________(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,_______________(填 “趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(3)将粗品PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图2所示:

①阴极的电极反应式为______________________;
②当有4.14gPb生成时,通过质子交换膜的n(H+)=______________________。
(4)PbI2可用于人工降雨。取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00 mL PbI2饱和溶液分次加入阳离子交换树脂RH+(发生反应:2RH++PbI2 =R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图3)。加入酚酞指示剂,用0.0050mol·L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液10.00mL。可计算出t℃时Ksp(PbI2)为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下表标出的是元素周期表的一部分元素,回答下列问题:
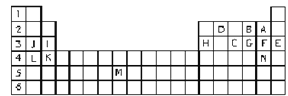
①表中用字母标出的14种元素中,化学性质最不活泼的是____________(用元素符号表示,下同),金属性最强的是____________,常温下单质为液态的非金属元素是____________。
②B、F、C气态氢化物中以________(填分子式)最不稳定。
Ⅱ. 有短周期的A、B、C、D、E 五种元素,它们在周期表的位置如图所示。已知A原子最外层电子数是次外层电子数的2倍。试回答下列问题:
![]()
(1) 元素E在周期表中位于第_______周期_______族。
(2) 元素A的最高价氧化物的电子式为________,元素D的原子结构示意图为________;
(3) 比较C、D两种元素最高价氧化物对应水化物的酸性强弱:______ > ______。(用分子式表示)
(4)元素C的气态氢化物与元素E的最高价氧化物对应水化物化合生成的正盐的化学式为___________,该盐的晶体类型为________。
(5) ①元素B所在周期的简单离子半径最小的是______。(用离子符号表示)
②元素C、D的简单氢化物沸点较高的是______。(用分子式表示)
(6)请用电子式表示Na2S的形成过程____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是一种药物中间体,A为原料的工业合成路线如下图所示。
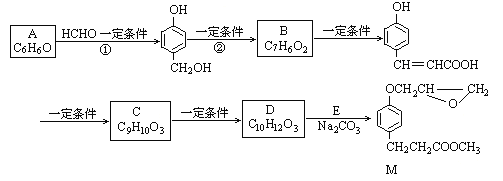
已知:RONa+R'X→ROR'+NaX
根据题意完成下列填空:
(1)写出化合物A的结构简式:______________________。
(2)反应②的反应类型为______________________。
(3)化合物X含有的官能团名称是______________________;该物质核磁共振氢谱共有________组峰。
(4)由C生成D的另一种反应物是_______________,反应条件是_________________。
(5)写出由D生成M的化学反应方程式: ______________________ 、_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中能大量共存的是
A.Na+、OH-、SiO32-、Cl-B.Fe3+、 NH4+、SCN-、Cl-
C.Fe2+ 、H+、Na+ 、MnO4-D.Na+、AlO2-、SO42-、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的四种短周期主族元素。其中X、Y为金属元素,W和Z同主族。Z的核外电子数是W的2倍,W和Z的质子数之和等于X和Y的质子数之和。下列说法不一定正确的是()
A. 原子半径:![]()
B. 工业冶炼Y的方法是电解熔融Y的氧化物
C. W和X组成的化合物为碱性氧化物
D. 向W、X、Y组成的化合物水溶液中滴入稀盐酸至过量,溶液先变浑浊后澄清
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是____和____(填化学式,且相对分子质量小的写在第一个空)。
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质记为C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时,产生棕黄色沉淀(红白混合颜色),向该沉淀中滴入稀硝酸,沉淀部分溶解,最后留有白色沉淀不再溶解。则X为____。
A.SO32- B.SO42- C.CH3COO- D.SiO32-
(3)B的水溶液不显中性,原因主要为______________________________(用离子方程式表示)。
(4)将0.02 mol A与0.01 mol C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为_____。
(5)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀硫酸,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的____________(填相应的离子符号)。有关反应的离子方程式为_______________________________________________。
(6)利用上述已经确定的物质,可能检验出D、E中的阳离子。请简述实验操作步骤、现象及结论:__________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com