
����Ŀ��Ǧ���仯�����ڹ�ҵ�����������о��зdz��㷺����;��
��1����Ŧ�Ʒ�����Ǧ������ط�Ӧ���Ȼ�ѧ����ʽ���£�
��2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ��H1��akJ��mol-1
��PbS(s)2PbO(s)=3Pb(s)+SO2(g) ��H2��b kJ��mol-1
��PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ��H3��c kJ��mol-1
��Ӧ3PbS(s)+6O2(g)=3PbSO4(s) ��H��____________kJ��mol-1���ú�a��b��c�Ĵ���ʽ��ʾ��
��2���Ժ�Ǧ���ϣ���Ҫ��Pb��PbO��PbO2��PbSO4��Ϊԭ���Ʊ��ߴ�PbO������Ҫ�������£�
�١����ܡ�ʱ����Fe2+���£�Pb��PbO2��Ӧ��1 mol PbSO4ʱת�Ƶ��ӵ����ʵ���Ϊ_________ mol��
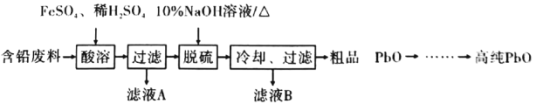
����֪��PbO�ܽ���NaOH��Һ�У����ڻ�ѧƽ�⣺PbO(s)+NaOH(aq)![]() NaHPbO2(aq)�����ܽ��������ͼ1��ʾ��
NaHPbO2(aq)�����ܽ��������ͼ1��ʾ��

���������Ϣ������ɴ�ƷPbO���������ʲ�����NaOH��Һ���õ��ߴ�PbO�IJ���������ƷPbO�ܽ���һ����________���35������10��������NaOH��Һ�У�������110�棬����ܽ��_______________���� �����ȹ��ˡ�������Ũ������������Һ��ȴ�ᾧ�����ˡ�ϴ�Ӳ�����õ��ߴ�PbO���塣
��3������ƷPbO�ܽ���HCl��NaCl�Ļ����Һ�У��õ���Na2PbCl4�ĵ��Һ�����Na2PbCl4��Һ����Pb��װ����ͼ2��ʾ��

�������ĵ缫��ӦʽΪ______________________��
�ڵ���4.14gPb����ʱ��ͨ�����ӽ���Ĥ��n(H+)=______________________��
��4��PbI2�������˹����ꡣȡһ������PbI2���壬������ˮ���Ƴ�t�汥����Һ��ȷ��ȡ25.00 mL PbI2������Һ�ִμ��������ӽ�����֬RH+��������Ӧ��2RH++PbI2 =R2Pb+2H++2I-������250ml�ྻ����ƿ��������Һ����������ˮ��ϴ��֬������Һ�����ԣ���ϴ��Һһ��ʢ�ŵ���ƿ�У���ͼ3���������ָ̪ʾ������0.0050mol��L-1NaOH��Һ�ζ������ﵽ�ζ��յ�ʱ����ȥ����������Һ10.00mL���ɼ����t��ʱKsp(PbI2)Ϊ_________________��
���𰸡� 2a+2b-3c 1 35% ���ȹ��� PbCl42-+2e-=Pb+4Cl- 0.04mol 4��10-9
����������1�����ݸ�˹������дĿ���Ȼ�ѧ����ʽ��
(2) �ٸ��ݵ�ʧ�����غ�������������з����ķ�ӦΪPbSO4+2NaOH=PbO+Na2SO4+H2O������Һ���к������ᣬ�ɽ�����Һ��pH��ʹƽ��PbO��s��+NaOH��aq��NaHPbO2��aq�������ƶ�������ܽ�������ص��֪Ũ�ȸߵ�NaOH��Һ�ͽϸߵ��¶ȣ�PbO���ܽ�ȸߣ��ݴ˷�����
��3��������������ԭ��Ӧ���ڸ���ת�Ƶĵ�������ͨ�����ӽ���Ĥ��n(H+)
��4��Ҫ�����t��ʱPbI2Ksp������Һ��CI2����CPb��ֵ��Ȼ����ݹ�ʽ��������
(1)��2PbS(s)+3O2(g)�T2PbO(s)+2SO2(g)��H1=akJmol1
��PbS(s)+2PbO(s)�T3Pb(s)+SO2(g)��H2=bkJmol1
��PbS(s)+PbSO4(s)�T2Pb(s)+2SO2(g)��H3=ckJmol1
���ݸ�˹���ɢ���2+����2����3�õ�3PbS(s)+6O2(g)�T3PbSO4(s)��H=2��H1+2��H23��H3=(2a+2b3c)kJmol1���ʴ�Ϊ��2a+2b3c��
��2������Fe2+���£�Pb��PbO2��Ӧ����PbSO4����ӦΪ��Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O������2molPbSO4ת�Ƶ���2mol��������1molPbSO4��ת�Ƶ��ӵ����ʵ�����1mol�ڸ���PbO���ܽ�����ߣ��ᴿ��Pb�ķ���Ϊ����PbO�ܽ���NaOH��Һ�У�����ܽ�������ص��֪Ũ�ȸߵ�NaOH��Һ�ͽϸߵ��¶ȣ�PbO���ܽ�ȸߣ���˼������ϸ��¶ȣ�����ܽ⣬Ȼ���ٸ����³��ȹ��˳�ȥ���ʣ�����Һ��ȴ�ᾧ�����ˡ�ϴ�Ӳ�����õ��ߴ�PbO���壻�ʴ�Ϊ����1��35%�����ȹ��ˣ�
2PbSO4+2H2O������2molPbSO4ת�Ƶ���2mol��������1molPbSO4��ת�Ƶ��ӵ����ʵ�����1mol�ڸ���PbO���ܽ�����ߣ��ᴿ��Pb�ķ���Ϊ����PbO�ܽ���NaOH��Һ�У�����ܽ�������ص��֪Ũ�ȸߵ�NaOH��Һ�ͽϸߵ��¶ȣ�PbO���ܽ�ȸߣ���˼������ϸ��¶ȣ�����ܽ⣬Ȼ���ٸ����³��ȹ��˳�ȥ���ʣ�����Һ��ȴ�ᾧ�����ˡ�ϴ�Ӳ�����õ��ߴ�PbO���壻�ʴ�Ϊ����1��35%�����ȹ��ˣ�
��3��������������ԭ��Ӧ������������Na2PbCl4��Һ������Pb��������ԭ��Ӧ����������ӦΪ��PbCl42-+2e-=Pb+4Cl-���ڵ���4.14gPb����ʱ��ת����0.04mol���ӣ����ͨ�����ӽ���Ĥ��n(H+)0.04mol���ʴ�Ϊ����PbCl42-+2e-=Pb+4Cl- ��0.04mol
��4���ζ����������ĵ�OH-����Ϊ�����ӽ�������H+��c(H+)=0.0025molL-1��20.00mL��25.00mL=2��10-3molL-1����2RH++PbI2 =R2Pb2++2H++2I-��֪c(H+)= c(I-)����c(Pb2+)= c(I-)/2=10-3������![]() 4��10-9
4��10-9
���ʴ�Ϊ4��10-9��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.���Ͳ�˿����Ҫ�ɷֶ�����ά��
B.��������һ����������ˮ�ⷴӦ����������
C.ø��һ����д����õĵ����ʣ���������к�ǿ��רһ�ԡ���Ч��
D.ʳ��ֲ���͵���Ҫ�ɷ��Dz�����֬��������������ڸ߷��ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2.3 g�����������ڸ�������б�������õ�3.5 g���壬�ɴ˿��жϳ�������
A. Na2O B. Na2O2
C. Na2O��Na2O2�Ļ���� D. ��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽ��ͼ��ʾ�����й��ڸ��л��������˵����ȷ����
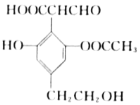
A. ����������Һ��Ӧ������FeCl3��Һ��Ӧ��ɫ
B. ������H2��Ӧ��Imol�������������5molH2
C. 1mol����������������Na��Ӧ��������2molH2
D. 1mol������NaOH��Һ��Ӧ���������4 molNaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��800��ʱ����2L���ܱ������з�����Ӧ��2NO(g)+O2(g)![]() 2NO2��n(NO)��ʱ��ı仯���±���ʾ��
2NO2��n(NO)��ʱ��ı仯���±���ʾ��
ʱ���Ms | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)�Mmol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1����0��3s�ڣ���NO��ʾ��ƽ����Ӧ������(NO)��_____________��
��2��ͼ�б�ʾNOŨ�ȱ仯��������_______(����ĸ����)��
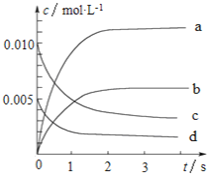
��3����ƽ��ʱNO��ת����Ϊ________��
��4����˵���÷�Ӧ�Ѵﵽƽ��״̬����_________(�����)��
A������������ɫ���ֲ���
B�����������ܶȱ��ֲ���
C������ (NO2)��2���� (O2)
D����������ƽ����Է����������ֲ���
��5�������µ�850�棬��ƽ���n(NO)��n(NO2)����Ӧ��________(��������Ӧ�����������淴Ӧ������)�ƶ���
��6������һ��������0.2molNO������������Ӧ����ƽ��ʱ��÷ų�������ΪakJ����ʱNOת����Ϊ80%����2molNO������ȫ��Ӧ�ų�������Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.��Ҫ���ȵķ�Ӧ��һ�������ȷ�Ӧ
B.��Ӧ�����������������������������������ȷ�Ӧ
C.һ���ȷ��ӣ�Cl��Cl�����2��Clԭ��ʱ��ų�����
D.��ʯ��Ͷ��ˮ�еķ�Ӧ�Ƿ��ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵķ�����ȷ���ǣ� ��
�� | �� | �� | ���������� | ���������� | |
A | Na2CO3 | H2SO4 | Cu2��OH��2CO3 | Fe2O3 | SO3 |
B | NaOH | HCl | NaCl | Na2O2 | CO |
C | NaOH | NaHSO4 | CaF2 | MgO | SO2 |
D | KOH | HNO3 | NaHCO3 | CaO | CO2 |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʽ������ͬ����
A. ![]() B. HCOOCH3��HOOCCH3
B. HCOOCH3��HOOCCH3
C.  D. -NO2��NO2
D. -NO2��NO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��һ��˫�н�,���õúû������������������ò��û��������������Ե����ѡ�
(1)��ս�ڼ��ձ���ս���ϴ���ʹ�ö�������Ķ����ǽ�����,�������Ľṹ��ʽΪ�� ClCH2CH2-S-CH2CH2Cl��
�ٽ��������ĸ�̼ԭ���Ƿ���һ��ֱ����________(��ǡ� ��)��
�ڽ������ĺ˴Ź�������ͼ����________�����շ壬������֮��Ϊ________��
(2)�պ��㴼��������ʳ���㾫����ṹ��ʽ��ͼ��ʾ��
![]()
���պ��㴼�ķ���ʽΪ________��
���������ʲ������պ��㴼������Ӧ����________ (ѡ�����)��
a�������� b��HBr c��Na2CO3��Һ d������
���պ��㴼��ͭ������ʱ����������Ӧ�Ļ�ѧ����ʽΪ________��
���պ��㴼������ȥ��Ӧ�Ļ�ѧ����ʽΪ____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com